Interstitielle Lungenerkrankungen: Grundlagen
Pneumologie
Definition und Einteilung
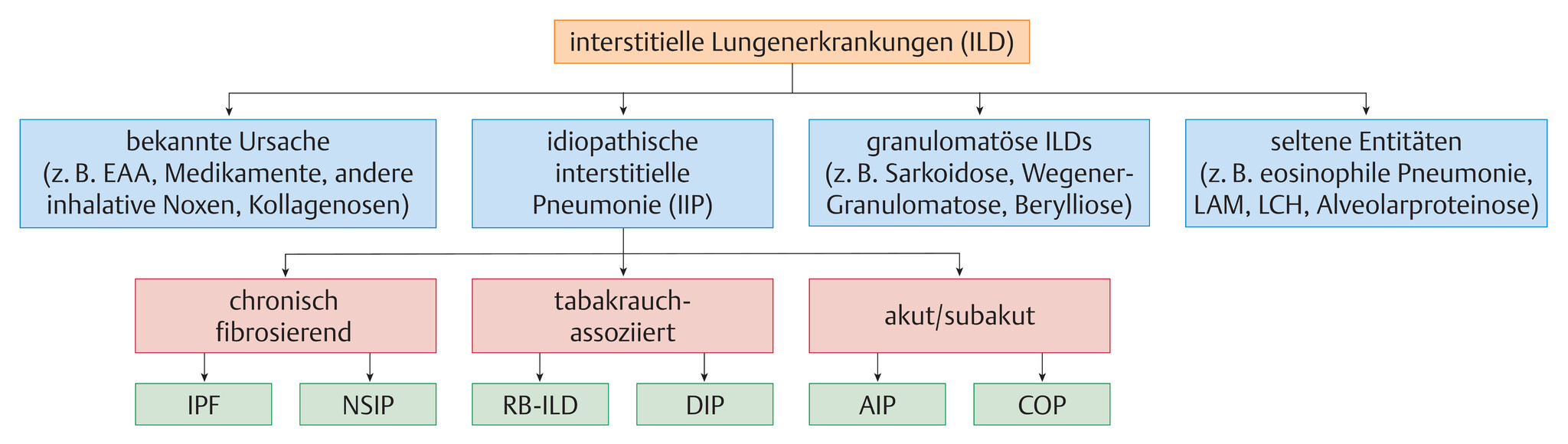
Die interstitiellen Lungenerkrankungen (ILDs) umfassen ein breites Spektrum an akut oder chronisch verlaufenden Krankheiten, die mit einer Entzündungsreaktion und/oder Fibrosierung des Lungenparenchyms einhergehen. Sie werden nach ätiologischen oder histopathologischen Kriterien klassifiziert (Abb. 81.1).
Da bei den ILDs nicht nur das Interstitium, sondern auch Endothel, Epithel, Alveolarräume und Bronchiolen am Krankheitsprozess beteiligt sein können, hat sich auch der Begriff „diffuse Lungenparenchymerkrankungen“ (DPLD) als Synonym etabliert.
Die Bedeutung dieser Krankheitsgruppe hat in den letzten Jahren trotz der relativen Seltenheit (geschätzte Prävalenz 60–100/100000) zugenommen. Dies ist darauf zurückzuführen, dass neue Erkenntnisse zur Pathogenese gewonnen wurden, die Diagnostik – insbesondere die HRCT – mittlerweile zwischen zahlreichen dieser Erkrankungen differenzieren kann und dass die antifibrotische Therapie erste Perspektiven einer Lebensverlängerung bei progressiv verlaufender Lungenfibrose ermöglicht.
Im Vordergrund der Differenzialdiagnostik steht die Abgrenzung der idiopathischen interstitiellen Pneumonien von Erkrankungen mit bekannter Ursache (z.B. exogen allergische Alveolitis (EAA), Asbestose) oder von Lungenbeteiligungen bei Systemerkrankungen wie Kollagenosen und Vaskulitiden. Selten kann eine Lungenfibrose auch bei entzündlichen Darmerkrankungen (Colitis ulcerosa, Morbus Crohn) oder der Neurofibromatose (hier oberlappenbetont) auftreten. Des Weiteren werden granulomatöse Erkrankungen (z.B. Sarkoidose) und seltene Entitäten mit besonderen klinischen und histopathologischen Charakteristika abgegrenzt (Abb. 81.1). Extrem selten ist eine ILD bei hereditären Lipidspeicherkrankheiten (Gaucher-Krankheit, Niemann-Pick-Krankheit).
Abb. 81.1 Klassifikation der interstitiellen Lungenerkrankungen.
EAA: exogen allergische Alveolitis ; LAM: Lymphangioleiomyomatose; LCH: Langerhans-Zell-Histiozytose; IPF: idiopathische pulmonale Fibrose; NSIP: nicht spezifische interstitielle Pneumonie; RB-ILD: respiratorische Bronchiolitis mit interstitieller Lungenerkrankung; DIP: desquamative interstitielle Pneumonitis; AIP: akute interstitielle Pneumonie; COP: kryptogene organisierende Pneumonie.
(Costabel U. Einteilung und Differenzialdiagnostik. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
(Costabel U. Einteilung und Differenzialdiagnostik. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
Progredient fibrosierende ILD
Während die idiopathische pulmonale Fibrose (IPF) fast immer progredient verläuft, können sich andere Lungenfibrosen unter Therapie stabilisieren oder verbessern. Bei etwa 20–35 dieser Nicht-IPF Entitäten (z.B. chronische EAA, fibrotische NSIP, Lungenfibrose bei Kollagenose) gestaltet sich der Verlauf allerdings trotz etablierter Therapie ähnlich progredient wie bei IPF. Man spricht dann von einer progredient fibrosierenden ILD (PF-ILD) bzw. von einer progressiven pulmonalen Fibrose (PPF), definiert durch eine funktionelle und/oder radiologische Verschlechterung bei zunehmender Symptomatik. Die Progression einer PF-ILD kann durch antifibrotische Therapie gebremst werden.
Diagnostik
- Die ILDs haben folgendes gemeinsam
- das unspezifische Leitsymptom der Luftnot, die zunächst nur bei Belastung, später auch in Ruhe auftritt
- die Lungenfunktionsstörung mit Restriktion und Diffusionsstörung
- die Bildgebung mit interstitiellen oder infiltrativen Veränderungen
- den klinischen Befund des Knisterrasselns, in unterschiedlicher Häufigkeit, fast immer bei der idiopathischen Lungenfibrose (IPF)
Diagnostisches Vorgehen
- Die Diagnostik bei ILDs verläuft unter folgenden Zielsetzungen:
- Zur Differenzierung gegenüber anderen Lungenkrankheiten tragen die oben beschriebenen Befunde bei (Knisterrasseln, Lungenfunktionsanalyse und Bildgebung).
- Zur ätiologischen Differenzierung zwischen den verschiedenen ILDs sind Anamnese, Laborwerte, HRCT-Muster, Bronchoskopie mit BAL-Differenzialzytologie und ggf. eine transbronchiale Biopsie (heute zunehmend als Kryobiopsie) hilfreich.
- Falls danach keine eindeutige Zuordnung zu einer definierten Krankheit möglich ist, ist in Abhängigkeit von Komorbidität und Alter des Patienten eine chirurgische Lungenbiopsie (heute meist als VATS) zur endgültigen Klärung in Erwägung zu ziehen.
Anamnese
- Der Anamnese kommt eine entscheidende Bedeutung zu.
- An den Patienten sind zahlreiche Fragen zu stellen. Sehr wichtig sind auch Fragen zum Rauchverhalten!
- Krankheitsbeginn: akut oder allmählich?
- Symptome im Verlauf: zunehmend, unverändert, anfallsweise?
- Allgemeinsymptomatik: Fieber, Nachtschweiß, Gewichtsabnahme, Fatigue-Syndrom?
- Extrapulmonale Symptome: gastroösophagealer Reflux, Dysphagie, Arthritis, Muskelschwäche, Hautveränderungen, neurologische Störungen, Augenveränderungen?
- Exposition gegenüber inhalativen Noxen im Beruf oder häuslichen Umfeld: Hinweis auf EAA, Pneumokoniose?
- Medikamente?
- Raucher oder Nichtraucher (Tab. 81.1)?
- Demografische Aspekte: höheres Lebensalter, Jugendlicher, Mann oder Frau?
- Familiäres Vorkommen einer ILD?
|
|
|
UIP = gewöhnliche interstitielle Pneumonie |
|
Klinische Untersuchung
- Vor allem ist auf Uhrglasnägel und Trommelschlägelfinger, Zyanose und Knisterrasseln zu achten.
- Sorgfältig sind Zeichen der Systemsklerose zu suchen (typische Hautveränderungen, Sklerodaktylie, verkürztes Zungenbändchen, Raynaud-Syndrom, Arthritis).
- Periphere Lymphknotenvergrößerungen, Hepatosplenomegalie, Löfgren-Syndrom und Sprunggelenksarthritis kommen bei Sarkoidose vor.
Labor
- Neben den Routineparametern der klinischen Chemie sind auch Rheumafaktor, ANA, ENA (Jo-1-Syndrom!), Bluteosinophilie, ACE und Präzipitine bedeutsam.
- Bei Verdacht auf Vaskulitis auch cANCA, pANCA sowie antiglomeruläre Basalmembranantikörper.
Bildgebung
Thorax-Radiologie
- Die radiologischen Befunde (Röntgen-Thorax, HRCT) sind nach Zeichnungsmuster und Verteilung der Veränderungen zu beurteilen: ob dominant im Oberfeld oder im Unterfeld, zentral oder peripher (hier wieder subpleural oder mit subpleuraler Aussparung) oder entlang der bronchovaskulären Bündel (Tab. 81.2).
-
Des Weiteren ist zu berücksichtigen, ob die Veränderungen diffus, segmental oder herdförmig ausgedehnt sind.
HRCT
- In der HRCT finden sich folgende Zeichnungsmuster:
- Milchglasveränderungen (die Dichte ist geringer als die der noch sichtbaren Gefäße)
- Konsolidierungen mit Luftbronchogramm (Gefäße nicht mehr sichtbar)
- intralobuläre feinretikuläre oder interlobuläre grobmaschige Fibrosierungen
- Traktionsbronchiektasen, Honigwabenbildungen, Zysten
- Mosaikmuster oder Tree-in-Bud-Phänomen bei Bronchiolitis
- Die Zeichnungsmuster sind ein Hinweis auf die verschiedenen ILDs (Tab. 81.3).
- Je nach „typischem“ Bild (Zeichnungsmuster und Lokalisation) erlaubt der HRCT-Befund eine Aussage zur zugrunde liegenden ILD (Tab. 81.4).
|
|
|
|
|
ILD = interstitielle Lungenerkrankung; HRCT = high-resolution computed tomography |
|||
|
UIP, nicht spezifische interstitielle Pneumonie, exogen allergische Alveolitis, Kollagenose, Asbestose |
|
|
Sarkoidose, Silikose, exogen allergische Alveolitis, respiratorische Bronchiolitis mit interstitieller Lungenerkrankung |
|
|
exogen allergische Alveolitis, nicht spezifische interstitielle Pneumonie, desquamative interstitielle Pneumonie, respiratorische Bronchiolitis mit interstitieller Lungenerkrankung, chronische eosinophile Pneumonie, Hämorrhagie, Alveolarproteinose |
|
|
Langerhans-Zell-Histiozytose, Lymphangioleiomyomatose, lymphozytäre interstitielle Pneumonie |
|
|
HRCT = high-resolution computed tomography; UIP = gewöhnliche interstitielle Pneumonie |
|
|
UIP mit Honigwabenmuster und/oder Traktionsbronchiolektasen |
|
|
Mikronoduli entlang bronchovaskulärer Bündel, mikronoduläre Konglomerate = „Galaxiezeichen“ |
|
|
Noduli, Ringschatten, unregelmäßig geformte Zysten |
|
|
dünnwandige Zysten |
|
|
pulmonale Alveolarproteinose |
geografisches Milchglas, Crazy-Paving-Muster |
|
ILD = interstitielle Lungenerkrankung; HRCT = high-resolution computed tomography; UIP = gewöhnliche interstitielle Pneumonie |
|
Instrumentelle Diagnostik
BAL
Die BAL ist insbesondere bei Milchglasveränderungen in der HRCT zur weiteren Differenzierung der zugrunde liegenden Krankheit wertvoll (Tab. 81.5). Sie kann dann z.B. eine starke Lymphozytose aufdecken (EAA sehr wahrscheinlich), einen hohen Anteil an Rauchermakrophagen bei normaler Differenzialzytologie (typisch für die RB-ILD) nachweisen oder einen hohen Anteil an eisenpositiven Makrophagen aufdecken (Hinweis auf alveoläre Hämorrhagie).
|
idiopathische pulmonale Fibrose, fibrotische nicht spezifische interstitielle Pneumonie, desquamative interstitielle Pneumonie, Kollagenosen, Asbestose |
|
|
Sarkoidose, exogen allergische Alveolitis, kryptogene organisierende Pneumonie, zelluläre nicht spezifische interstitielle Pneumonie, medikamenteninduziert, lymphozytäre interstitielle Pneumonie |
|
|
gemischtförmig (Lymphozyten/neutrophile Granulozyten/eosinophile Granulozyten) |
kryptogene organisierende Pneumonie, chronische exogen allergische Alveolitis, nicht spezifische interstitielle Pneumonie, Kollagenosen |
|
respiratorische Bronchiolitis mit interstitieller Lungenerkrankung, desquamative interstitielle Pneumonie, Langerhans-Zell-Histiozytose |
|
|
Amiodaron, exogen allergische Alveolitis, Gaucher-Krankheit, Niemann-Pick-Krankheit |
|
Transbronchiale Zangenbiopsie
- Ob neben der BAL auch eine transbronchiale Zangenbiopsie durchgeführt werden sollte, hängt vom HRCT-Befund ab.
- Die Trefferquoten sind hoch bei peribronchial betonten Veränderungen, bei generalisierten Milchglasänderungen und Konsolidierungen.
- Nicht diagnostisch ist die transbronchiale Zangenbiopsie bei peripheren Veränderungen, wie sie den meisten Formen der IIPs zugrunde liegen. In diesen Fällen wird sie nicht mehr empfohlen.
Transbronchiale Kryobiopsie
- Im Vergleich zur Zangenbiopsie können mit dieser neuen Methode deutlich größere Gewebeproben (Durchmesser 5–10mm) ohne Kompressionsartefakte gewonnen werden, allerdings zu Lasten eines höheren Pneumothorax- und Blutungsrisikos.
- Die Mortalität ist deutlich niedriger als bei der chirurgischen Lungenbiopsie, welche inzwischen an vielen Zentren nur noch bei nicht diagnostischer Kryobiopsie eingesetzt wird.
- In etwa 80% der Fälle kann mithilfe der Kryobiopsie eine konfidente MDD-Diagnose gestellt werden.
Intraoperative Diagnostik
Chirurgische Lungenbiopsie
Falls eine chirurgische Lungenbiopsie (heute meist in VATS-Technik) für notwendig erachtet wird, ist Folgendes zu bedenken:
- kein erhöhtes Risiko (Komorbiditäten, Schweregrad der Lungenfunktionseinschränkung beachten)
- Festlegung der Seite und Segmente unter Berücksichtigung des HRCT-Befundes
- Mehretagenbiopsie (Biopsate aus 2–3 Lappen)
- keine Biopsie im Bereich von Honigwaben
Literatur
Literatur zur weiteren Vertiefung
- [1] George PM, Spagnolo P, Kreuter M et al. Progressive fibrosing interstitial lung disease: clinical uncertainties, consensus recommendations, and research priorities. Lancet Respir Med 2020; 8: 925–934
Suche in: PubMed Google Scholar - [2] Travis WD, Costabel U, Hansell DM et al. An official American Thoracic Society/European Respiratory Society statement: update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am J Respir Crit Care Med 2013; 188: 733–748
Suche in: PubMed Google Scholar
Quelle
Costabel U. Interstitielle Lungenerkrankungen: Grundlagen. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/f-0008-0001-b-006-163265
eRef-Link: https://eref.thieme.de/11TTFUQW