Idiopathische Lungenfibrose (IPF)
Pneumologie
Steckbrief
Die idiopathische Lungenfibrose ist eine chronische, progredient und meist tödlich verlaufende fibrosierende interstitielle Pneumonie unbekannter Ursache. Sie tritt primär bei älteren Erwachsenen, überwiegend bei Männern und Rauchern/Exrauchern auf, ist auf die Lunge beschränkt und mit dem histopathologischen und/oder radiomorphologischen Muster einer „Usual Interstitial Pneumonia“ (UIP) assoziiert. Die mittlere Überlebenszeit nach Diagnosestellung beträgt unbehandelt nur 3–5 Jahre. Die IPF ist die häufigste Form der IIPs (Anteil 50–60%), gefolgt von NSIP und COP mit jeweils 15–30%. Heute kann eine progressionshemmende antifibrotische Therapie zur Lebensverlängerung führen.
Synonyme
- idiopathische pulmonale Fibrose
Keywords
- idiopathische Lungenfibrose, IPF, idiopathische interstielle Pneumonie
Definition
- Die IPF ist definiert als eine chronische, progredient verlaufende, fibrosierende interstitielle Pneumonie unbekannter Ursache, die primär bei älteren Erwachsenen auftritt, auf die Lungen begrenzt ist und mit dem histopathologischen und/oder radiologischen Muster einer UIP einhergeht.
- Die Diagnose setzt den Ausschluss anderer Formen interstitieller Lungenerkrankungen voraus, insbesondere anderer idiopathischer interstitieller Pneumonien sowie den Ausschluss von ILDs in Zusammenhang mit Umweltbelastungen, Medikamenten oder systemischen Erkrankungen.
Epidemiologie
- Die IPF ist die häufigste Entität der IIPs, tritt typischerweise nach dem 50. Lebensjahr vorwiegend bei Männern und Rauchern/Exrauchern auf.
Häufigkeit
- Inzidenz: 10–20/100000, je nachdem, ob die Krankheit eng (mit sicherem UIP-Muster) oder breit (unter Einschluss auch anderer IIPs) definiert wird. Mit steigendem Lebensalter nimmt die Inzidenz exponentiell zu.
- Prävalenz: 30–60/100000. Inzidenz und Prävalenz nehmen in den letzten Jahren zu. Für die USA wird bis zum Jahre 2050 eine Verdoppelung angenommen. In Deutschland rechnet man aktuell mit 20000 Patienten.
Altersgipfel
- Der Altersgipfel bei Krankheitsmanifestation liegt zwischen dem 60. und 70. Lebensjahr.
- IPF-Patienten <50 Jahren sind selten und entwickeln später oft eine manifeste, zum Diagnosezeitpunkt noch okkulte Kollagenose, oder es handelt sich um eine familiäre Form.
Geschlechtsverteilung
- Verhältnis Männer/Frauen: etwa 2:1
Prädisponierende Faktoren
- Rauchen
- Umgang mit Metallstäuben und Holzstaub
- möglicherweise latente Virusinfektionen (EBV, Hepatitis C, CMV, humanes Herpesvirus)
- gastroösophagealer Reflux (möglicherweise jedoch kein Risikofaktor, sondern sekundäre Folge der steifen Lunge mit konsekutiver Erweiterung der Kardia)
- genetische Faktoren (MUC5B-Polymorphismen, Mutationen in Surfactant-Protein- und Telomerase-Genen; Auftreten von familiären Formen bei ca. 5% aller IPF-Patienten)
Ätiologie und Pathogenese
- Ätiologie ist per definitionem unbekannt.
- Pathogenese: Konzept der fehlgeleiteten Wundheilung: inflammatorische Vorgänge, bis vor wenigen Jahren noch bedeutsam in der frühen Phase der IPF, spielen höchstens noch sekundär eine Rolle.
- Nach initialer Schädigung des Alveolarepithels (z.B. durch Viren, inhalative Noxen, zelluläre Altersvorgänge) gehen die Typ-II-Pneumozyten durch vorzeitige Apoptose zugrunde.
- Gestörter Umsatz des Alveolarepithels führt zur Hyperplasie der verbleiben Typ-II-Pneumozyten, welche vermehrt profibrotische Zytokine freisetzen.
- Diese bewirken, dass sich alveoläre Epithelzellen in Fibroblasten umwandeln (Epithel-Mesenchym-Transformation).
- Vermehrter Zustrom zirkulierender Fibrozyten in die Lungen, die sich dort zu Fibroblasten transformieren können.
- Oxidativer Stress mit Bildung von reaktiven Sauerstoffmetaboliten führt zur Aktivierung profibrotischer Prozesse.
- Endresultat: Fibroblastenproliferation und -aktivierung, gesteigerte Kollagensynthese und schließlich irreversibler fibrotischer Umbau des Lungengewebes.
Symptomatik
- Führendes Symptom ist die Luftnot bei Belastung, anfangs leichtgradig und nur bei starken Belastungen auftretend, später bereits bei geringster Anstrengung.
- Trockener Husten ist oft begleitend.
- Symptome uncharakteristisch und bestehen oft Monate, bevor sie abgeklärt werden;
- viele Patienten schieben die Beschwerden auf den allgemeinen Alterungsprozess
- Allgemeinsymptome wie Gewichtsverlust und Müdigkeit sind selten.
- Komorbiditäten:
- Lungenemphysem: dieses Zusammentreffen wird auch als kombinierte pulmonale Fibrose mit Emphysem (CPFE) bezeichnet; funktionell zeigen sich relativ gut erhaltene Volumina bei erheblich eingeschränktem Gasaustausch, gehäuft auch eine pulmonale Hypertonie, letztere bestimmt die schlechtere Prognose im Vgl. zur IPF ohne Emphysem
- gastroösophagealer Reflux (GERD): nur symptomatischer Reflux sollte behandelt werden
- pulmonale Hypertonie: Behandlung nur bei überproportional hohem Druck in Relation zur Restriktion
- koronare Herzkrankheit
- schlafbezogene Atmungsstörungen
- Lungenkarzinom (Häufigkeit 10% bei IPF)
Diagnostik
- Der Diagnoseverdacht stellt sich bei einem älteren Patienten, der die o.g. Symptome und endinspiratorisches Knisterrasseln aufweist.
- Die Diagnose wird oft verzögert gestellt.
Diagnostisches Vorgehen
- insgesamt hohe Variabilität bei den Betroffenen hinsichtlich des Alters bei Diagnosestellung, der Ausprägung der Hyperglykämie, der benötigten Therapie wie Insulin oder der Entwicklung von Folgeerkrankungen
- bei neonatalem Diabetes ohne Hinweis auf andere Organanomalien, negativen Autoantikörpern und fehlender exokrine Pankreasinsuffizienz hat die molekulargenetische Panelanalysen mittlerweile die Sequenzierung einzelner Kandidatengene abgelöst:
- Anomalien des Chromosoms 6q24 (TNDM)
- Mutationen des KCNJ11-Gens (PNDM, TNDM)
- Mutationen des ABCC8-Gens (PNDM, TNDM)
- Mutationen des Insulingens (PNDM)
- bei verminderter Elastase im Stuhl und negativer molekulargenetischer Analyse bezüglich Chromosom 6q24, KCNJ11-, ABCC8- und INS-Gen sowie negativen oder positiven Autoantikörpern: Untersuchung auf seltenere genetische Erkrankung/genetisches Syndrom (z.B. Pankreasaplasie)
- Abb. 10.17 zeigt das diagnostische Vorgehen bei Diabetesmanifestation bis zum 6. Lebensmonat, gegebenenfalls bis zum 1. Lebensjahr.
- In Abb. 10.18 ist das diagnostisches Vorgehen bei Manifestation im Jugendalter abgebildet.
- Bei klinischem Verdacht auf MODY kann zunächst zwischen den häufigsten Formen (GCK- und HNF1A-MODY) unterschieden werden.
- GCK-MODY hat typischerweise einen schwachen Anstieg im oralen Glukosetoleranztest, während der HNF1A-MODY im oralen Glukosetoleranztest eine ausgeprägte Insulinsekretionsstörung mit deutlichem Blutzuckeranstieg zumeist über 60 mg/dl (3,5mmol/l) zeigt.
- K-ATP-Kanaldefekte und sehr seltene, rezessive Formen oder Diabetessyndrome müssen aufgrund des spezifischen Symptommusters molekulargenetisch untersucht werden.
| Merke Früherkennung durch Auskultation: latero- und/oder dorsobasal endinspiratorisches Knisterrasseln bei >90% der IPF-Patienten! |
Diagnosekriterien
- Ausschluss anderer bekannter Ursachen einer ILD (z.B. häusliche und berufliche Umweltbelastung, insbesondere im Hinblick auf eine exogen allergische Alveolitis, Kollagenosen, Medikamente)
- UIP-Muster in der HRCT
- bestimmte Musterkombinationen in der HRCT und der Histopathologie bei Patienten mit Lungenbiopsie
Diagnostisches Vorgehen
- Diagnose der IPF ist immer auch eine Ausschlussdiagnose:
- UIP-Muster ist nicht spezifisch für die IPF
- kann sich auch bei chronischer exogen-allergischer Alveolitis, Kollagenosen, medikamenteninduzierter Alveolitis und Asbestose finden
- Abgrenzung gegenüber anderen chronisch progredienten Lungenfibrosen ist angesichts der unterschiedlichen Therapieansätze von großer Bedeutung.
- Diagnostik erfolgt stufenweise:
- ausführliche Anamnese
- körperliche Untersuchung
- Lungenfunktion
- Labor mit Autoimmunserologie und spezifischen IgG-Antikörpern gegen vermutete EAA-Antigene
- HRCT und BAL
- ggf. ergänzt durch Lungenbiopsie (s. Abb. 83.1)
- Multidisziplinäre Diskussion durch erfahrene Experten in einer interdisziplinären Fallkonferenz gilt heute als Goldstandard bei der Diagnosestellung einer ILD.
- Diagnose IPF wird in der Synopsis klinischer, radiologischer und histopathologischer Befunde zunehmend sicherer.
Anamnese
- s.a. Symptomatik
- sorgfältige Anamnese mit zahlreichen gezielten Fragen zum Ausschluss anderer ILDs und zu Risikofaktoren
- Exposition gegen Antigene der exogen-allergischen Alveolitis?
- Kollagenosezeichen?
- Verdächtige Medikamente?
- Familiäres Vorkommen einer ILD?
Körperliche Untersuchung
- Auskultation: beidseits basal betont, anfangs nur laterobasal, später auch in den Mittel- und Oberfeldern endinspiratorisches Knisterrasseln.
- Uhrglasnägel und Trommelschlägelfinger in 60–70%
- im fortgeschrittenen Stadium häufig auch Lippenzyanose und klinische Zeichen des Cor pulmonale
| Merke End-inspiratorisches Knisterrasseln ist ein sehr frühes Zeichen und lässt sich bei >90% der Patienten feststellen. |
Labor
- Laborparameter zum Ausschluss einer Kollagenose (Autoimmunserologie, insbesondere ANA, Rheumafaktor) und einer EAA (spezifische IgG-Antikörper gegen vermutete Allergene) sind sinnvoll
Bildgebende Diagnostik
HRCT
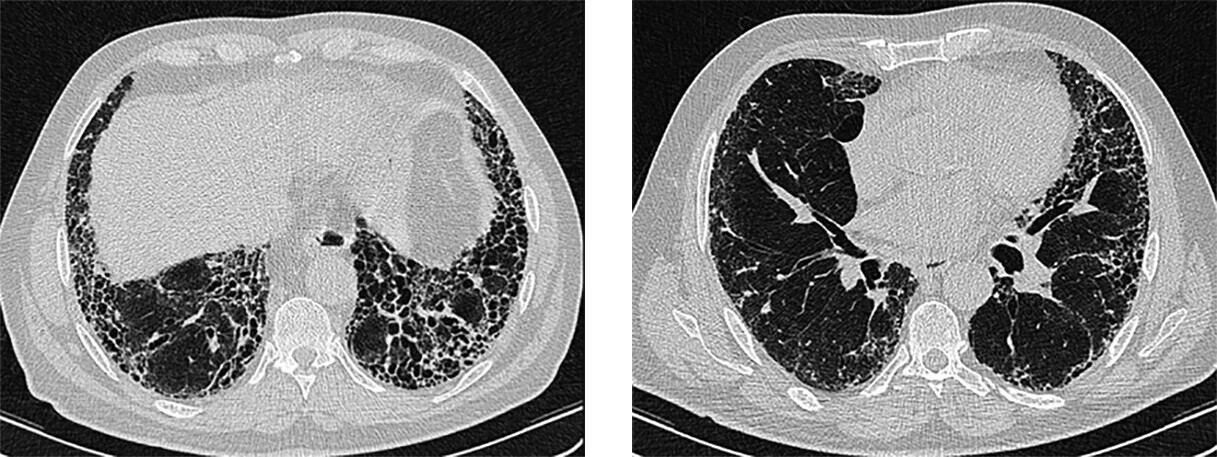
- dem Erkennen des UIP-Musters in der HRCT kommt die überragende diagnostische Rolle zu (Abb. 83.2); Honigwaben in der HRCT definieren das sichere UIP-Muster; sie werden am häufigsten mit paraseptalen Emphysemblasen oder Traktionsbronchiektasen verwechselt (Differenzierung: Honigwaben ausschließlich subpleural, mehrschichtig, mit deutlich abgrenzbaren Wänden)
- 4 diagnostische HRCT-Kategorien:
- sicheres UIP-Muster: subpleural und basal betont, oft heterogen; Honigwaben; Retikulationen mit peripheren Traktionsbronchiektasen/-bronchiolektasen
- wahrscheinliches UIP-Muster: wie sicheres UIP-Muster, aber keine Honigwaben
- unbestimmt für eine UIP: fibrotische Veränderungen, die aber nicht die Kriterien eines sicheren oder wahrscheinlichen UIP-Musters erfüllen
- alternative Diagnose: HRCT-Muster, die für eine Nicht-IPF-Diagnose sprechen, wie perilymphatische oder peribronchovaskuläre Verteilung mit subpleuraler Aussparung, Ober- oder Mittelfeldbetonung, dominante Konsolidierungen, ausgedehnte Milchglasverdichtungen, ausgeprägtes Mosaikmuster, diffuse Mikronoduli oder Zysten
Abb. 83.2 HRCT bei IPF.
Links mit Honigwaben (sicheres UIP-Muster), rechts ohne Honigwaben aber mit Traktionsbronchiolektasen (wahrscheinliches UIP-Muster).
(Costabel U, Wessendorf T. Idiopathische Lungenfibrose (IPF). Diagnostik. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
(Costabel U, Wessendorf T. Idiopathische Lungenfibrose (IPF). Diagnostik. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
Instrumentelle Diagnostik
Lungenfunktion
- Kombination von Restriktion und Diffusionsstörung. Die Gasaustauschstörung ist bei Patienten mit zusätzlichem Emphysem oft stärker ausgeprägt als die Restriktion. Der 6-Minuten-Gehtest (6-MWT) erfasst die körperliche Belastbarkeit
- forcierte Vitalkapazität (FVC) und der 6-MWT korrelieren mit dem Schweregrad der IPF und sind unabhängige Prädiktoren für die Mortalität
- Lungenfunktion kann bei früher IPF noch normal sein
BAL
- BAL zeigt typischerweise, aber unspezifisch, eine leichte bis mittelgradige Granulozytose aus Neutrophilen und einem etwas geringerem Eosinophilenanteil
- sie ist hilfreich zur Abgrenzung von Differenzialdiagnosen
- bei einer BAL-Lymphozytose >30% ist eine IPF unwahrscheinlich, dann ist an eine chronische exogen allergische Alveolitis, NSIP, COP oder andere ILD mit lymphozytärer BAL zu denken
Histologie, Zytologie und klinische Pathologie
Histologische Lungendiagnostik
- Transbronchiale Zangenbiopsie: in der Diagnostik der IPF und auch anderer idiopathischer interstitieller Pneumonien mit peripheren CT-Veränderungen nicht hilfreich.
- Transbronchiale Kryobiopsie: diese ersetzt zunehmend die chirurgische Lungenbiopsie (geringere Mortalität bei fast vergleichbarer diagnostischer Ausbeute).
- Chirurgische Lungenbiopsie (heute in der Regel als VATC):
- falls ein sicheres UIP-Muster vorliegt, wird eine chirurgische Lungenbiopsie nicht empfohlen
- auch nicht bei einem wahrscheinlichen UIP-Muster bei einem Patienten mit kompatiblem klinischem IPF-Bild;
- bei den anderen HRCT-Mustern ist bei Patienten ohne erhöhtes Risiko (jüngeres Lebensalter, keine Komorbidität, noch relativ gute Lungenfunktion) in einer interdisziplinären Fallkonferenz zu entscheiden
- ob Lungenbiopsie erforderlich
- ob klinischen/radiologischen/BAL-Daten ausreichen, um konfidente Diagnose stellen zu können
| Merke Der Pathologe sollte die 4 Kategorien der histopathologischen Muster kennen und als Grundlage für seine Befundung nutzen (Tab. 83.1). |
|
|
Differenzialdiagnosen
- Differenzialdiagnostisch kommt neben den IIPs und Kollagenose-assoziierten ILDs insbesondere die chronische exogen-allergische Alveolitis in Betracht.
- Auch eine Lymphangiosis carcinomatosa sowie eine Lungenstauung bei Linksherzinsuffizienz sind auszuschließen.
Therapie
- Therapieziele sind:
- Fortschreiten der Erkrankung aufhalten
- Überlebenszeit verlängern
- Risiko akuter Exazerbationen reduzieren
- Symptome lindern
Therapeutisches Vorgehen
- Stabilisierung ist das wichtigste Ziel der antifibrotischen Pharmakotherapie
- 2 zugelassene Medikamente: Pirfenidon und Nintedanib
- weitere Therapiekomponenten:
- flankierende supportive und palliative Maßnahmen (z.B. Antitussiva bei Bedarf)
- Behandlung von Komplikationen und Komorbiditäten
- Lungentransplantation für geeignete Patienten
Pharmakotherapie
- Die beiden antifibrotischen Medikamente haben einen vergleichbaren Effekt und sind in der Lage, die Krankheitsprogression zu verlangsamen, dadurch die Überlebenszeit zu verlängern und die Inzidenz der akuten Exazerbationen und anderer akuter respiratorischer Verschlechterungen zu reduzieren. Stark positive Empfehlung in der Deutschen IPF-Leitlinie.
- Pirfenidon, in der Dosis von 2400mg/d
- zugelassen zur Therapie der leichten bis mittelschweren IPF in Deutschland seit 2011.
- nicht zugelassen für die schwere IPF und für andere Formen der Lungenfibrose
- Nebenwirkungen: insbesondere Fotosensibilisierung (regelmäßige Anwendung von Sonnenschutzmittel mit Lichtschutzfaktor 50 empfohlen) sowie Magen-/Darmunverträglichkeiten
- Nintedanib (2×150mg/d)
- zugelassen zur Behandlung der IPF aller Schweregrade in Deutschland seit 2015
- Nebenwirkungen: Diarrhö und Übelkeit
- Wann Therapiebeginn? Symptomatischen Patienten mit einer definitiven IPF-Diagnose soll ab dem Zeitpunkt der Diagnosestellung eine antifibrotische Behandlung empfohlen werden (Empfehlung der Deutschen IPF-Leitlinie).
- Kombinationstherapie mit Pirfenidon und Nintedanib wird nicht empfohlen, solange nicht durch kontrollierte Studien eine stärkere Wirksamkeit der Kombination im Vergleich zur Einzeltherapie belegt ist.
- Die früher übliche antiinflammatorische Therapie mit Prednison/Azathioprin oder die Tripel-Therapie mit Prednison/Azathioprin/N-Acetylcystein wird nicht mehr empfohlen. Einzig zur Behandlung der akuten Exazerbation kann eine kurzfristige hochdosierte intravenöse Kortikosteroid-Stoßtherapie angewandt werden.
Operative Therapie
Lungentransplantation
| Merke Frühzeitig sollte an die Listung zur Lungentransplantation gedacht werden. |
- Internationale Leitlinien empfehlen, dass Patienten mit IPF, die jünger als 65 Jahre alt sind, zur Lungentransplantation evaluiert werden sollten, wenn:
- die CO-Diffusionskapazität <35% des Sollwerts beträgt
- und/oder die FVC <50% des Sollwerts beträgt
- oder sich innerhalb von 6 Monaten um >10% des Sollwerts verschlechtert
- und/oder eine arterielle Sauerstoffsättigung <89% im 6-Minuten-Gehtest bei Patienten ohne Sauerstoffgabe in Ruhe eintritt
Therapie von Komplikationen und Komorbiditäten
- Die weiteren supportiven Maßnahmen und Behandlungen von Komplikationen sind in Tab. 83.2 aufgezeigt.
- Von einer invasiven Beatmung sollte bei Patienten mit IPF und akuter Exazerbation oder respiratorischem Versagen aus anderen Gründen Abstand genommen werden.
|
mechanische Beatmung (IPF-bedingt) |
||
|
gezielte Therapie der pulmonalen Hypertonie |
||
Verlauf und Prognose
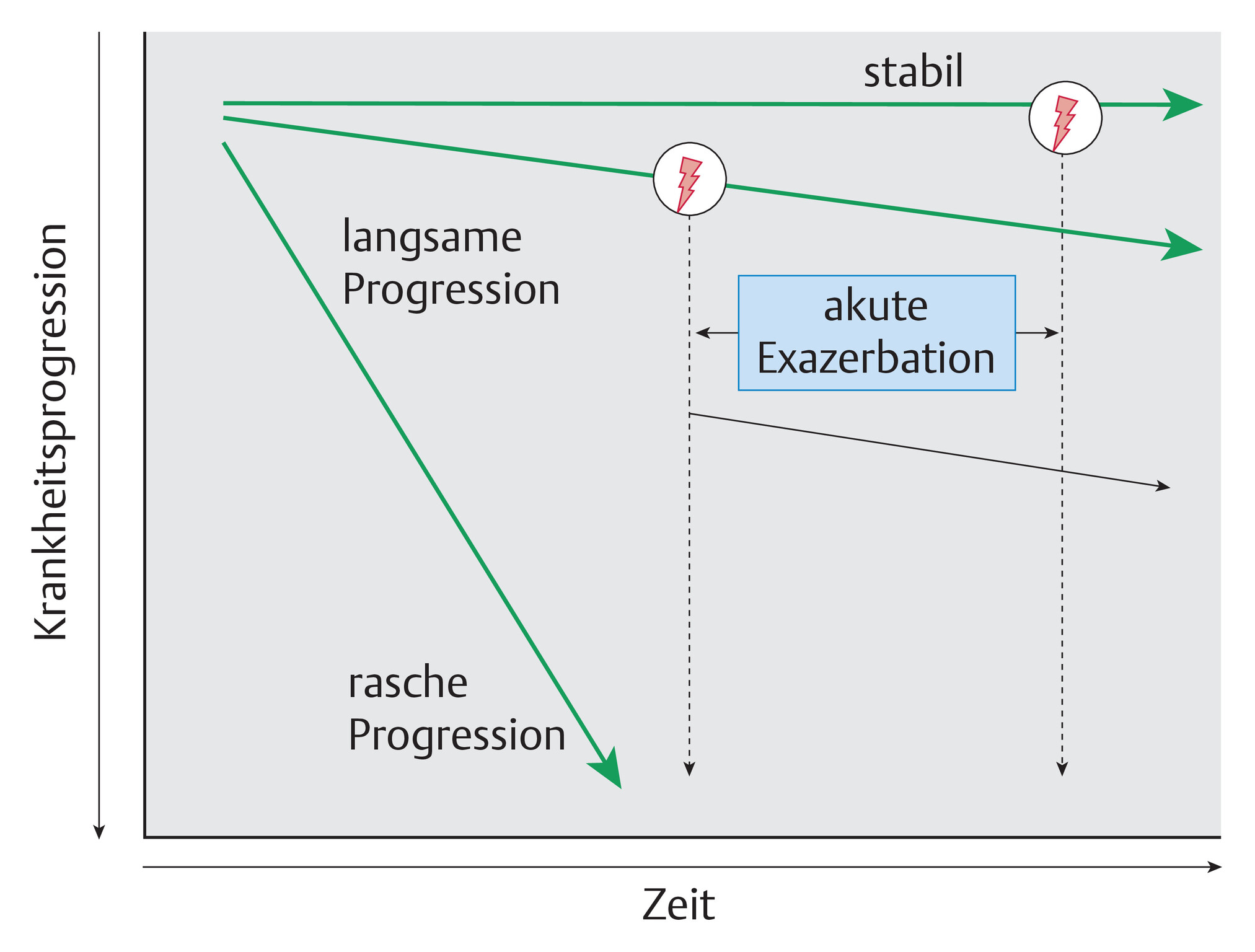
- Der Spontanverlauf der IPF zeichnet sich meist durch eine progrediente Verschlechterung aus, die unterschiedlich schnell verlaufen kann.
- Die mittlere Überlebenszeit nach Diagnosestellung beträgt unbehandelt 3–5 Jahre und kann durch antifibrotische Therapie vermutlich um etwa 50% verlängert werden.
- Der mittlere Verlust der FVC beträgt etwa 200ml pro Jahr.
- Sehr selten kann der Verlauf über Jahre hinweg stabil sein.
- Eine akute Verschlechterung ist jederzeit möglich (Abb. 83.3).
Abb. 83.3 Krankheitsverlauf der IPF.
(Quelle: Costabel U, Wessendorf T. Idiopathische Lungenfibrose (IPF). Verlauf und Prognosefaktoren. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. doi:10.1055/b-002-57146)
(Quelle: Costabel U, Wessendorf T. Idiopathische Lungenfibrose (IPF). Verlauf und Prognosefaktoren. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. doi:10.1055/b-002-57146)
Akute Exazerbation der IPF
- Bei dieser gefürchteten Komplikation kommt es innerhalb von wenigen Tagen bis Wochen (definitionsgemäß innerhalb von 1 Monat) zur Zunahme der Dyspnoe und zu neuen beidseitigen milchglasartigen Infiltraten in der HRCT, ohne dass sich dafür eine Ursache erkennen lässt (Ausschluss von Pneumonie, Linksherzinsuffizienz, Lungenembolie, Pneumothorax).
- Eine akute Exazerbation kann jederzeit im Verlauf auftreten (jährliche Inzidenz 5–15%), gehäuft im fortgeschritteneren Krankheitsstadium und ist manchmal auch der Grund für die Erstdiagnose.
- Trotz Kortisonpulstherapie ist die Prognose schlecht, meist sterben die Patienten innerhalb von wenigen Wochen bis Monaten nach diesem Ereignis.
Prognosefaktoren
Mit der Abnahme der FVC lässt sich die Prognose am besten vorhersagen. Nimmt sie in 6 Monaten um absolut 5–10% (des Sollwerts) ab, verdoppelt sich die Mortalität im nächsten Jahr, bei einer Abnahme >10% steigt die Mortalität um das 4- bis 8-Fache. Daher ist die FVC-Abnahme eine wichtige Zielgröße in der Verlaufsbeobachtung und auch ein geeigneter Endpunkt für Studien zur Therapie der IPF (Surrogatmarker für das Überleben). Weitere Faktoren, die mit einer erhöhten Mortalität einhergehen, sind:
- Ausgangsbefunde:
- Schweregrad der Dyspnoe
- Diffusionskapazität (DLCO) <40% des Sollwerts
- Abfall der transkutanen O2-Sättigung ≤88% während des 6-MWT
- Ausmaß der Honigwabenbildung in der HRCT
- pulmonale Hypertonie
- Verlaufsbefunde:
- Zunahme der Dyspnoe
- Abnahme der FVC ≥10% (absolut)
- Abnahme der DLCO ≥15% (absolut)
- Abnahme der Gehstrecke im 6-MWT um >50m
- Zunahme der Fibrose in der HRCT
Verlaufskontrollen
- Da sich mit der Abnahme der FVC die Prognose am besten vorhersagen lässt, ist sie eine der wichtigsten Zielgrößen in der Verlaufskontrolle.
- Klinische Untersuchungen und Lungenfunktionskontrollen sollten alle 3–4 Monate erfolgen, HRCT-Kontrollen nicht routinemäßig.
- Im Rahmen der Reevaluation ist zu prüfen, ob folgendes in Betracht kommt:
- Therapieumstellung
- Sauerstoffverordnung
- pulmonale Rehabilitation
- Indikation für Lungentransplantationslistung
Literatur
Literatur zur weiteren Vertiefung
- [1] Anonymous. American Thoracic Society/European Respiratory Society Consensus classification of idiopathic interstitial pneumonias. Am J Respir Crit Care Med 2002; 165: 277–304
Suche in: PubMed Google Scholar - [2] Behr J, Günther A, Bonella F et al.: S2K-Leitlinie Idiopathische Lungenfibrose – Update zur medikamentösen Therapie 2017. Pneumologie 2017; 71: 460–474
Suche in: PubMed Google Scholar - [3] Behr J, Günther A, Bonella F et al.: S2K-Leitlinie zur Diagnostik der idiopathischen Lungenfibrose. Pneumologie 2020; 74: 245–314
Suche in: PubMed Google Scholar - [4] du Bois RM, Weycker D, Albera C et al. Forced vital capacity in patients with idiopathic pulmonary fibrosis: test properties and minimal clinically important difference. Am J Respir Crit Care Med 2011; 184: 1382–1389
Suche in: PubMed Google Scholar - [5] Lynch DA, Sverzellati N, Travis WD et al. Diagnostic criteria for idiopathic pulmonary fibrosis: a Fleischner Society White Paper. Lancet Respir Med 2018; 6: 138–135
Suche in: PubMed Google Scholar - [6] Noble PW, Albera C, Bradford WZ et al. CAPACITY Study Group. Pirfenidone in patients with idiopathic pulmonary fibrosis (CAPACITY): two randomised trials. Lancet 2011; 377: 1760–1769
Suche in: PubMed Google Scholar - [7] Raghu G, Collard HR, Egan JJ et al. ATS/ERS/JRS/ALAT Committee on Idiopathic Pulmonary Fibrosis. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med 2011; 183: 788–824
Suche in: PubMed Google Scholar - [8] Raghu G, Remy-Jardin M, Myers JL et al: Diagnosis of idiopathic pulmonary fibrosis. .An official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med 2018; 198: e44-e68
Suche in: PubMed Google Scholar - [9] Richeldi L, du Bois R, Raghu G et al.: Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med 2014; 370: 1079–1087
Suche in: PubMed Google Scholar - [10] Travis WD, Costabel U, Hansell DM et al. An official American Thoracic Society/European Respiratory Society statement: update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am J Respir Crit Care Med 2013; 188: 733–748
Suche in: PubMed Google Scholar
Quelle
Costabel U, Wessendorf T. Idiopathische Lungenfibrose (IPF). In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/f-0008-0003-b-006-163265
eRef-Link: https://eref.thieme.de/11XSKD2T