Interstitielle Lungenerkrankungen
Intensivmedizin
Steckbrief
Interstitielle Lungenerkrankungen repräsentieren eine heterogene Gruppe von teils akuten, zum Großteil aber chronischen Erkrankungen, die das Interstitium und/oder die Alveolen betreffen. Indikationen zur intensivmedizinischen Aufnahme umfassen akute Exazerbationen, Pneumothoraces, (pulmonale) Infekte, kardiovaskuläre Ereignisse sowie Rechtsherzdekompensationen. Die Diagnostik dieser Komplikationen umfasst in der Regel ein HRCT, Laborparameter und die Echokardiografie. Die Therapie richtet sich nach der Ursache, bei der akuten Exazerbation kommen i.d.R. hoch dosierte Steroide zum Einsatz.
Aktuelles
- Im Jahr 2022 wurden die aktualisierte deutsche S2K-Leitlinie zur Pharmakotherapie der idiopathischen Lungenfibrose (ein Update) und anderer progredienter pulmonaler Fibrosen [27] und im Jahr 2023 die deutsche S1-Leitlinie zur Interdisziplinären Diagnostik interstitieller Lungenerkrankungen im Erwachsenenalter [28] publiziert.
Synonyme
- diffus parenchymale Lungenerkrankungen (DPLD)
- interstitielle Lungenerkrankungen (ILE; international: ILD)
Keywords
- parenchymatöse Lungenerkrankung
- akutes und chronisches Lungenversagen
- idiopathische Lungenfibrose (IPF)
- akute Exazerbation (AE)
- Pharmakotherapie
- Beatmung
- Ethik am Lebensende
Definition
-
Interstitielle Lungenerkrankungen (ILD) repräsentieren eine heterogene Gruppe von teils akuten, zum Großteil aber chronischen Erkrankungen, die das Interstitium und/oder die Alveolen betreffen und durch „spezifische“ klinische, radiologische und pathologische Kriterien definiert sind. Der Krankheitsverlauf ist individuell sehr variabel und reicht von lange klinisch stabil bis sich langsam oder rasch progredient verschlechternd. Eine akute Exazerbation ist definiert als zunehmende Dyspnoe in weniger als einem Monat mit im CT neuem bilateralem Milchglas und/oder Konsolidierungen (auf dem Hintergrund einer Fibrose) sowie einer Verschlechterung, die nicht durch kardiale Faktoren oder Flüssigkeitsüberlagerung erklärbar ist.
Epidemiologie
Die nachfolgenden Ausführungen zur Epidemiologie beziehen sich auf akute Exazerbation der interstitiellen Lungenfibrose (AE-IPF).
Häufigkeit
- Interstitielle Lungenerkrankungen zählen zu den seltenen Erkrankungen. Die Häufigkeit einer stationären Aufnahme der Patienten aufgrund akuter Verschlechterungen ist gemäß aktuellen Daten aus Deutschland relativ hoch: Jährlich werden etwa 10–20% der Betroffenen wegen akuter respiratorischer Verschlechterungen aufgenommen.
- Aufgrund der wesentlichen Bedeutung der akuten Exazerbationen der idiopathischen Lungenfibrose (IPF) wird im Folgenden im Wesentlichen auf dieses Krankheitsbild näher eingegangen.
- akute Exazerbation der interstitielle Lungenfibrose:
- Die Krankenhausmortalität liegt bei ca. 50% und die mittlere Überlebenszeit beträgt weniger als 3 Monate.
- Die jährliche Inzidenz beträgt ca. 5–20% [23]. AE-IPF sind mit einer hohen Krankenhausaufnahmerate und einer häufigen Indikation zur intensivmedizinischen Therapie verbunden.
Altersgipfel
- Der Altersgipfel der idiopathischen Lungenfibrose liegt jenseits des 60. Lebensjahrs.
Geschlechtsverteilung
- Es sind mehr Männer als Frauen von einer idiopathischen Lungenfibrose betroffen.
Prädisponierende Faktoren
- männliches Geschlecht
- operative, insbesondere thoraxchirurgische Eingriffe (z.B. chirurgische Lungenbiopsie, Lungenkarzinom-OP)
- bronchoskopische, diagnostische Eingriffe wie transbronchiale Biopsien und bronchoalveoläre Lavage (BAL)
- fortgeschrittene lungenfunktionelle Einschränkung
- pulmonale Hypertonie
- ausgeprägte Fibrose im hochauflösenden CT (HRCT)
- Immunsuppression und/oder Chemotherapie
- Mikroaspirationen im Rahmen einer Refluxerkrankung
- Infekte:
- Viren (Herpesviren, Torque-Teno-Virus); saisonale Häufung (Jahreszeit mit einem erhöhten Risiko zwischen Dezember bis Mai)
- möglicherweise auch bakteriell bei nachgewiesenem verändertem Mikrobiom während einer akuten Exazerbation im Vergleich zur stabilen Phase
Ätiologie und Pathogenese
- Die Ätiologie der AE-IPF ist weitgehend unklar, es sind jedoch die oben genannten Assoziationen bzw. Risikofaktoren bekannt. Die Pathophysiologie beinhaltet – soweit bekannt – chronische Faktoren wie eine epitheliale Zelldysfunktion, eine Fibroblastenakkumulation und -aktivierung sowie akute Faktoren wie akuten pulmonalen Stress und akute Lungenverletzungen (ALI).
- Die akute Exazerbation wird wahrscheinlich durch ein akutes Ereignis ausgelöst wie eine Infektion, Mikroaspirationen oder einen mechanischen Stress, was eine diffuse alveoläre Schädigung (DAD) zur Folge hat.
Klassifikation und Risikostratifizierung
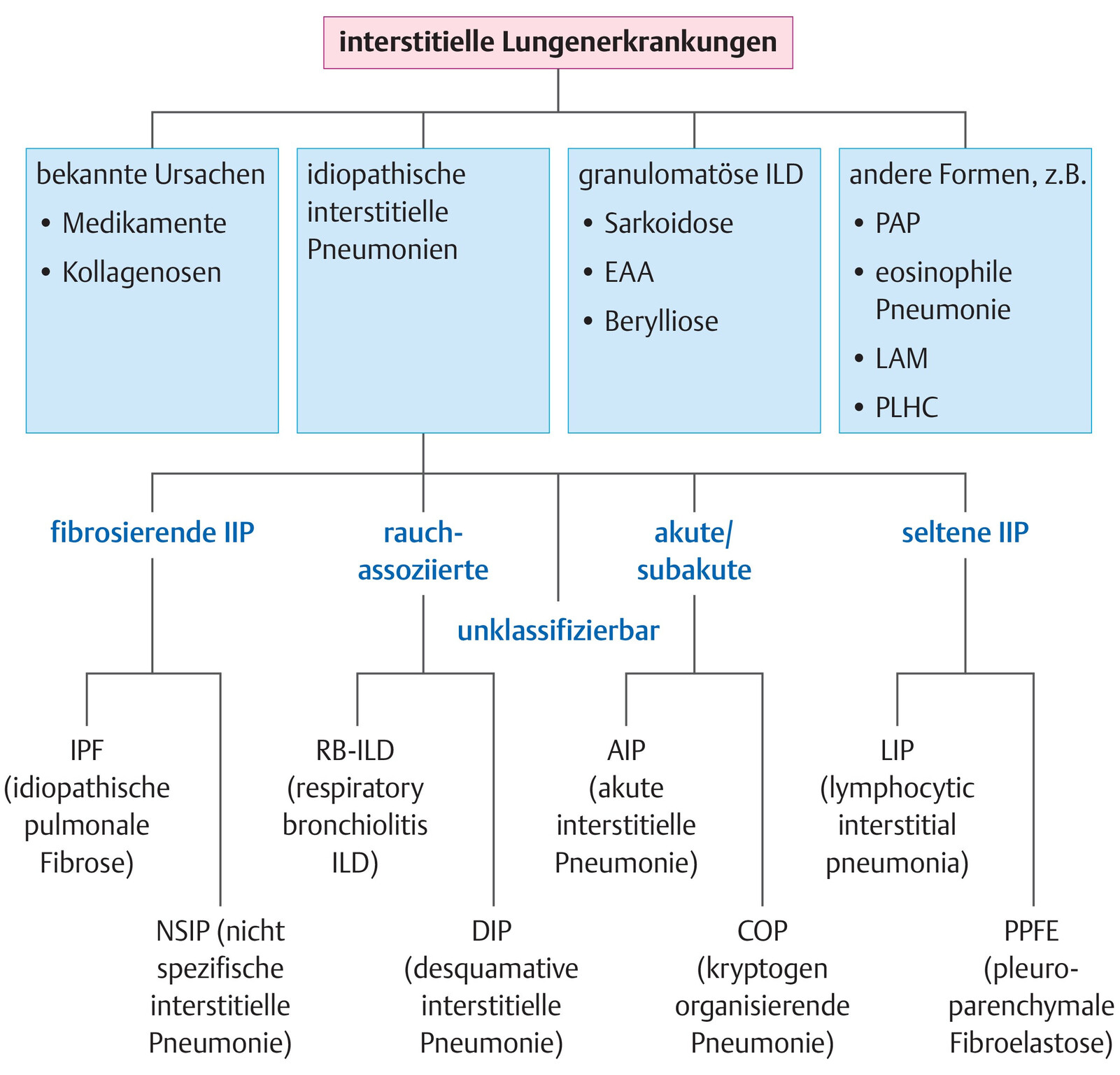
- Interstitielle Lungenerkrankungen werden in verschiedene Gruppen unterteilt (Abb. 36.1):
- interstitielle Lungenerkrankungen bekannter Ursache, z.B. durch Medikamente oder kollagenoseassoziiert
- idiopathische interstitielle Pneumonien, z.B. idiopathische Lungenfibrose (IPF)
- granulomatöse Erkrankungen, z.B. Sarkoidose oder exogen allergische Alveolitis
- weitere ILD, z.B. eosinophile Pneumonien, pulmonale Alveolarproteinose, pulmonale Langerhans-Zell-Histiozytose und Lymphangioleiomyomatose
Abb. 36.1 Interstitielle Lungenerkrankungen (ILD).
Klassifikation (EAA: exogen allergische Alveolitis, PAP: pulmonale Alveolarproteinose, LAM: Lymphangioleiomyomatose, PLHC: pulmonale Langerhanszell-Histiozytose, IIP: idiopathische interstitielle Pneumonie, RB-ILD: respiratorische bronchiolitisassoziierte ILD) [24].
Symptomatik
-
akute Verschlechterung der AE-IPF im Sinne einer Zunahme der Dyspnoe innerhalb von wenigen Tagen bis maximal 4 Wochen
Diagnostik
Diagnostisches Vorgehen
- Die Diagnose vor allem der fibrosierenden interstitiellen Lungenerkrankungen (wie IPF, chronische exogen allergische Alveolitis, kollagenoseassoziierte ILD u.a.) wird nicht selten erst im fortgeschrittenen Stadium der Erkrankung gestellt und sollten interdisziplinär erfolgen.
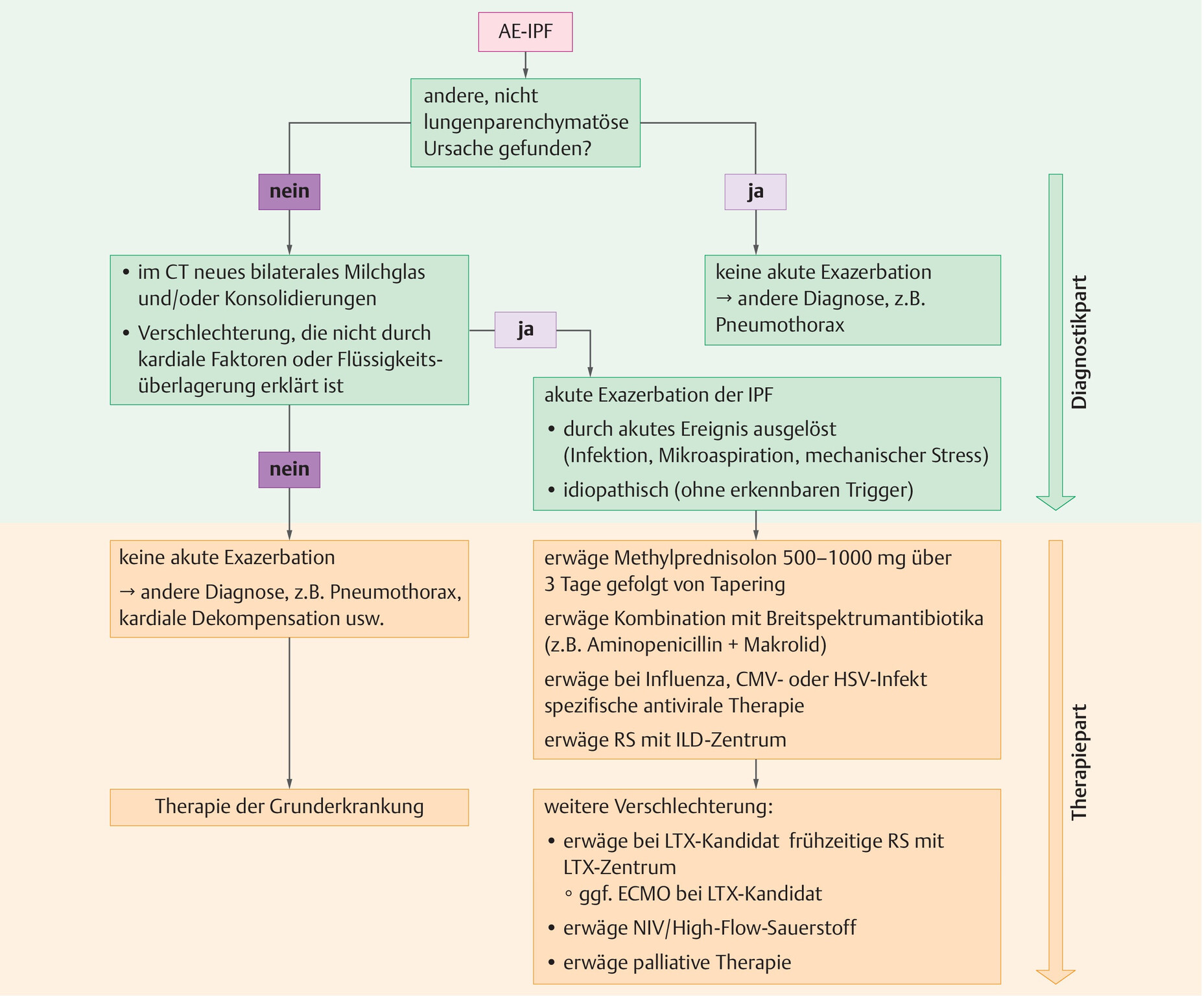
- Bei Patienten mit dem Verdacht einer AE-IPF sollte neben einer Anamnese, der körperlichen Untersuchung und Auskultation ein hochauflösendes, natives CT (HRCT), d.h. obligat ohne Kontrastmittel, durchgeführt werden (Abb. 36.2).
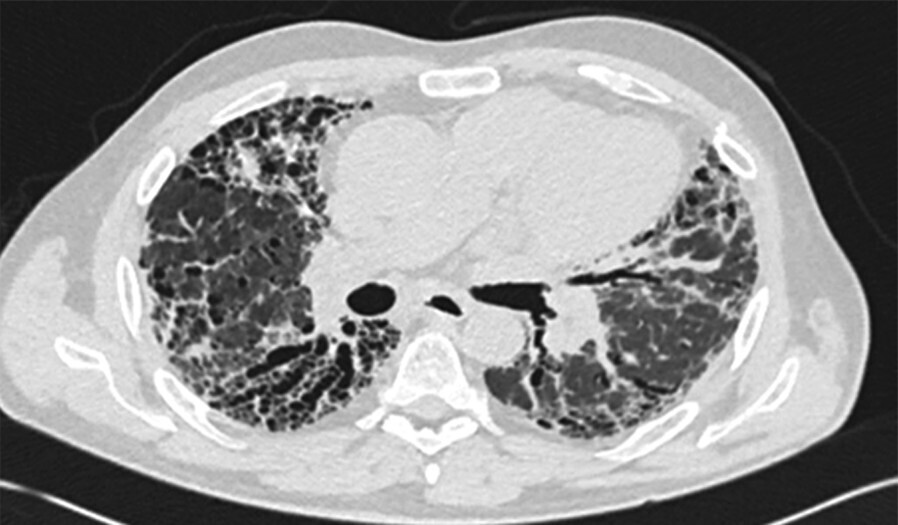
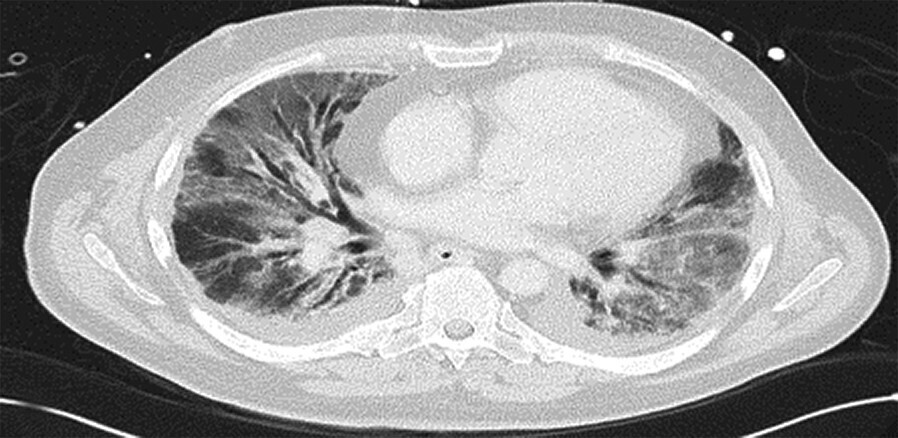
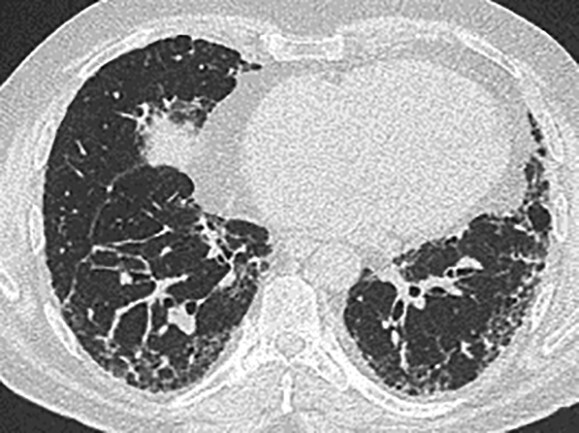
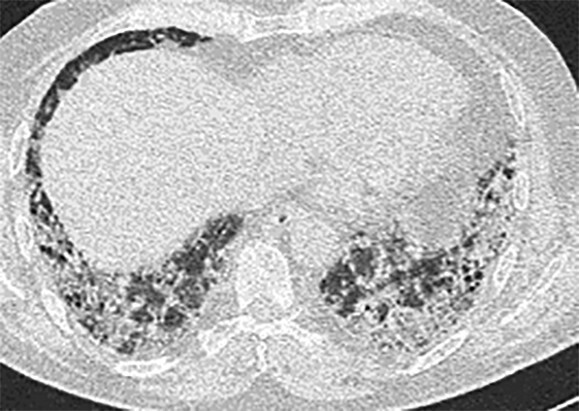
- Radiomorphologisch findet man bei einer akuten Exazerbation einer bestehenden Lungenfibrose Milchglasverschattungen, teilweise auch Konsolidierungen auf dem Boden fibrotischer Veränderungen (Abb. 36.3a). Bei einer akuten interstitiellen Pneumonie (AIP), die sich klinisch ähnlich äußert, fehlen die fibrosierenden Veränderungen (Abb. 36.3b).
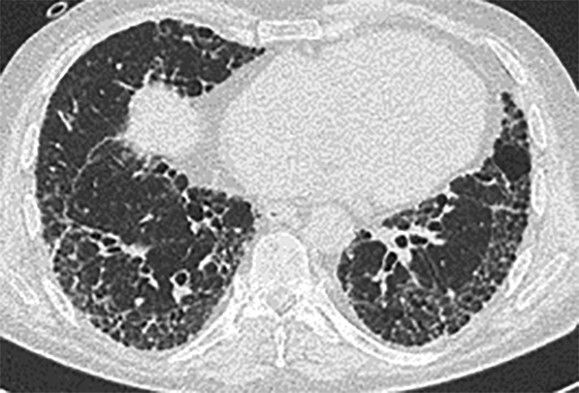
- Ein HRCT-Verlauf eines Patienten vor, während und nach einer akuten Exazerbation bei bestehender IPF ist in Abb. 36.4 dargestellt.
Abb. 36.2 Akute Exazerbation einer idiopathischen Lungenfibrose.
Empfohlener Diagnose- und Therapiealgorithmus. Bei anderweitiger Ursache einer akuten Verschlechterung sollte die Grunderkrankung therapiert werden (AE-IPF: akute Exazerbation, CMV: Cytomegalievirus, ECMO: extrakorporale Membranoxygenierung, HSV: Herpes-simplex-Virus, ILD: interstitielle Lungenerkrankung, IPF: idiopathische Lungenfibrose, LTX: Lungentransplantation, NIV: nicht invasive Ventilation, RS: Rücksprache).
Abb. 36.3 Radiologie bei akuter Exazerbation einer idiopathischen Lungenfibrose (IPF) und akuter interstitieller Pneumonie (AIP).
In beiden Fällen sieht man ausgedehntes Milchglas, jedoch nur bei der IPF auch das „UIP-Muster “mit den Honigwaben und Traktionsbronchiektasen).
a HRCT eines Patienten mit akuter Exazerbation einer IPF. (Quelle: Prof. Heußel und Prof. Kreuter, Thoraxklinik Heidelberg)
b HRCT eines Patienten mit AIP. (Quelle: Prof. Heußel und Prof. Kreuter, Thoraxklinik Heidelberg)
Abb. 36.4 Akute Exazerbation einer idiopathischen Lungenfibrose (AE-IPF) und akuter interstitieller Pneumonie (AIP).
Radiologie (mit freundlicher Genehmigung von Prof. Heussel und Prof. Kreuter, Thoraxklinik Heidelberg).
a 3 Monate vor der akuten Exazerbation zeigt sich radiomorphologisch ein milde ausgeprägtes mögliches „UIP-Muster“. (Quelle: Prof. Heußel und Prof. Kreuter, Thoraxklinik Heidelberg)
b Zum Zeitpunkt der AE-IPF finden sich ausgedehnte bilaterale Milchglasverschattungen und Konsolidierungen. (Quelle: Prof. Heußel und Prof. Kreuter, Thoraxklinik Heidelberg)
c 6 Monate nach der AE-IPF zeigt sich eine deutliche Zunahme der fibrotischen Veränderungen mit nahezu kompletter Rückbildung der Milchglasveränderungen. (Quelle: Prof. Heußel und Prof. Kreuter, Thoraxklinik Heidelberg)
Anamnese
- Beschwerdezunahme innerhalb von 4 Wochen
Körperliche Untersuchung
- Bei fibrosierenden interstitiellen Lungenerkrankungen ist häufig ein inspiratorisches Knisterrasseln zu hören, die so genannte Sklerosiphonie, spezifische Zeichen der AE-ILD gibt es nicht. Klinisch sollten Aspekte der Differenzialdiagnosen beachtet werden.
Labor
- keine Angabe
Differenzialdiagnosen
- Eine Unterscheidung zwischen einer akuten Exazerbation einer chronisch verlaufenden interstitiellen Lungenerkrankung oder einer akuten interstitiellen Pneumonie (AIP) kann schwierig sein und kann bei klinisch ähnlichem Krankheitsbild durch das Vorliegen eines zugrunde liegenden Fibrosemusters in manchen Fällen differenziert werden. Bei beiden Krankheitsgruppen findet sich Milchglas als Ausdruck des typischen Alveolarschadens.
- Weitere Differenzialdiagnosen sind in Tab. 36.1 aufgeführt.
|
Infekte können ebenfalls zu einer AE-ILD führen. Vor allem klinische und laborchemische Infektzeichen sind zu bedenken. Eine hochauflösende CT (HRCT) ist fast immer obligat, eine Unterscheidung zwischen einer idiopathischen AE-ILD und einem Infekt ist oft nicht möglich. Daher ist oft ein pragmatisches Vorgehen mit Antibiose und Steroidgabe notwendig. |
|
|
häufige Komplikation, ggf. D-Dimere und CT-Angiografie erwägen |
|
|
Rechtsherzdekompensation bei neu aufgetretener oder vorbestehender pulmonaler Hypertonie |
Eine pulmonale Hypertonie liegt oft auch im Rahmen der AE-ILD vor; klinische Zeichen u.a. Beinödeme, echokardiografischer Nachweis eines erhöhten Pulmonalisdrucks |
|
klinisch zu erwägen, ggf. initial Röntgen-Thorax, Drainageeinlage in Lokalanästhesie, Thorakoskopie vermeiden |
|
|
prognostisch ungünstiges Zeichen, gelegentlich Zufallsbefund bei der HRCT |
|
|
therapieassoziierte Toxizitäten (Medikamentenassoziation, infektiöse Komplikationen bei Leukozytopenie) |
schwierige Differenzialdiagnose, vor allem klinisch zu erwägen |
Therapie
Therapeutisches Vorgehen
- Zur Therapie von akuten Exazerbationen liegen bisher noch keine kontrollierten Studien zum Einsatz von Steroiden vor. Dennoch wird aktuell eine hochdosierte Steroidtherapie empfohlen; eine aktuelle französische randomisiert, Placebo kontrollierte Studie untersucht den Stellenwert der Studie und wird wahrscheinlich 2026 publiziert werden. Nicht empfohlen werden zur Therapie der AE-IPF Cyclophosphamid und rekombinantes Thrombomodulin, die beide in randomisiert-kontrollierten Studien untersucht wurden und keinen Vorteil für behandelte Patienten erbrachten. Neben der Steroitherapie wird in vielen Fällen eine antibiotische Therapie appliiert. Relevant sind zudem Beatmungsmanagement, v.a. high-flow Sauerstoff sowie ggf. eine palliative Therapie.
- Grundsätzlich stehen neben pharmakologischen Maßnahmen (z.B. Immunsuppression, Antibiotika und antifibrotische Therapie) auch interventionelle Therapieverfahren (z.B. Beatmung) zur Verfügung. Ein Therapiealgorithmus ist in Abb. 36.2 dargestellt.
Pharmakotherapie
Immunsuppression/Steroidtherapie
- Eine verbindliche Dosierungsempfehlung existiert nicht; aufgrund der u.a. Daten zu Cyclophosphamid ist neben einer häufiger gewählten Dosis von 500 mg Methylprednisolon über 3 Tage ggf. auch eine niedrigere Dosis von 100 mg Prednisolon i.v. über 3 Tage zu erwägen.
- Cyclophosphamid solle aufgrund neuster Daten NICHT mehr in der Therapie der akuten Exazerbation eingesetzt werden, da es keine Wirkung zeigte und ggf. mit einer höheren Mortalität assoziiert ist.
Antibiotika
- Da Patienten mit einer akuten Exazerbation häufig einen Symptomkomplex präsentieren, der einer infektiösen Genese ähnelt, erhalten viele Patienten zusätzlich zu der hochdosierten Steroidtherapie eine antibiotische Therapie; allerdings ist das Evidenzlevel zu diesem Vorgehen niedrig. Meist werden Breitbandantibiotika wie Aminopenicilline mit Makroliden kombiniert. Der Therapie mit Makroliden liegt die Annahme zugrunde, dass diese neben der antibiotischen auch eine antientzündliche Wirkung aufweisen. Jüngst wurde eine retrospektive Analyse zu einer Makrolidtherapie veröffentlicht [12], die über einen positiven Einfluss auf das Überleben im Vergleich zu einer Gyrasehemmergabe berichtete, prospektive Daten liegen allerdings nicht vor.
Antifibrotika
- Im Zusammenhang mit akuten Exazerbationen der idiopathischen Lungenfibrose (IPF) kommt antifibrotischen Therapieprinzipien eine wichtige Bedeutung zu. Aktuell sind zur Langzeittherapie der IPF zwei Antifibrotika zugelassen: Nintedanib und Pirfenidon. Im Rahmen der Zulassungsstudien zu Nintedanib waren akute Exazerbationen ein wichtiger sekundärer Endpunkt. Kombinierte Analysen aller bisherigen Studien für Nintedanib konnten signifikante Einflüsse auf eine niedrigere Inzidenz einer akuten Exazerbation (AE-IPF) zeigen [20].
- Für Pirfenidon ist dies weniger untersucht; Posthoc-Analysen zeigen jedoch einen positiven Effekt auf die Hospitalisationsrate [15]. Aus diesen Daten könnte man ableiten, dass 1. eine antifibrotische Therapie während einer akuten Exazerbation fortgeführt werden bzw. 2. falls noch nicht eingeleitet, im Rahmen der Exazerbation initiiert werden sollte. In retrospektiv erhobenen Daten ergaben sich Hinweise, dass der Beginn einer antifibrotischen Therapie mit Pirfenidon oder Nintedanib während oder zeitnah nach der AE-IPF zu einer Verbesserung der Prognose führen kann [6].
Neue Therapiemethoden
- Zudem wurden in letzter Zeit Ergebnisse zu neuen Behandlungsstrategien für akute Exazerbationen analysiert. Hierzu zählen der Einsatz von Thrombomodulin, ein Plasmaaustausch kombiniert mit Rituximab sowie eine Hämoperfusion mit Polymyxin-B-immobilisierten Fasersäulen. Jedoch liegen derzeit außer negativen Daten für Thrombomodulin, welches daher definitiv nicht mehr eingesetzt werden sollte, nur Daten aus retrospektiven Analysen vor, die noch in prospektiven Studien näher untersucht werden müssen [9], [10], [17].
Interventionelle Therapie
Beatmung und Ersatzverfahren
- Die Prognose von Patienten, die im Rahmen einer akuten Exazerbation invasiv maschinell beatmet werden, ist meist infaust. In der deutschen Leitlinie wird daher von einer mechanischen invasiven Beatmung abgeraten, wenn die Ursache in einer raschen Progression der IPF liegt [3]. Nur bei potenziell reversiblen Ursachen wie Lungenarterienembolie, bakterieller Pneumonie oder in der Vorbereitung einer Lungentransplantation sollte erwogen werden, die invasive Beatmung überbrückend durchzuführen. Die Anwendung einer nicht invasiven Beatmung kann – auch unter palliativen Gesichtspunkten – hilfreich sein; sie muss aber mit dem Patienten und den Angehörigen abgestimmt werden.
- Eine aktuelle Publikation vergleicht in einer retrospektiven Erhebung 1703 Patienten mit IPF, die invasiv beatmet wurden mit 778 Patienten, die eine nicht invasive Beatmung (NIV) erhielten; die Mortalitätsrate lag bei 51,6% für invasive Beatmung versus 30,9% für die Patienten mit NIV [21]. Auch unsere klinische Erfahrung legt nahe, dass sich im Einzelfall durch eine nicht invasive Beatmung eine Intubation von Patienten mit AE-IPF vermeiden lässt.
- Durch die Anwendung einer VV-ECMO (venovenösen extrakorporalen Membranoxygenierung) können Lungenschäden, die unter einer mechanischen Beatmung durch die hohen Beatmungsdrücke verursacht werden, möglicherweise verhindert werden. Bei Patienten, die keine Kandidaten für eine Lungentransplantation sind, scheint ein solches Vorgehen nicht mit einer Prognoseverbesserung assoziiert zu sein und sollte daher derzeit nur in klinischen Studien eingesetzt werden.
High-Flow-Sauerstofftherapie
- Um die Oxygenierung und Ventilation bei Patienten mit AE-ILD zu verbessern, wurde der Effekt nicht-invasiver Atemunterstützung in mehreren Studien untersucht [25], [26]. Der Effekt der High-Flow-Sauerstoff-Therapie auf physiologische Parameter scheint der NIV nicht unterlegen zu sein. High-Flow-Sauerstoff-Therapie bietet jedoch einen hohen Komfort. Bei Verschlechterung der Oxygenierung und Ventilation unter High-Flow-Sauerstoff-Therapie sollte frühzeitig auf NIV umgestellt werden. In zukünftigen Studien mit größeren Studienpopulationen ist der Effekt von High-Flow-Sauerstoff zur Therapie der AE-ILD auf Outcomeparameter (wie z.B. Mortalität) im direkten Vergleich mit NIV zu untersuchen.
Palliativmedizin
- In vielen Fällen ist die Prognose eines Patienten mit einer akuten Exazerbation einer interstitiellen Lungenerkrankung, insbesondere einer idiopathischen Lungenfibrose, sehr schlecht. Bei Patienten, die nicht für eine Lungentransplantation infrage kommen, sollten frühzeitig auch palliativmedizinische Maßnahmen erwogen und diese, soweit möglich, mit dem Patienten und seiner Familie besprochen werden. Hier stehen symptomatische Therapien, zu der auch High-Flow-Sauerstofftherapie und ggf. eine NIV zählen können, sowie eine Linderung der schweren Dyspnoe mit Morphinderivaten und andere ähnliche pharmakotherapeutische Maßnahmen im Vordergrund [14].
Verlauf und Prognose
- Folgen der akuten Exazerbation sind neben einer hohen Letalität signifikante funktionelle und klinische Verschlechterungen (gemessen an der forcierten Vitalkapazität, der Diffusionskapazität und Parametern der Lebensqualität).
- Nach aktuellen Studienergebnissen liegt die Krankenhausmortalität bei >50% und die 1- bzw. 5- Jahres-Mortalität bei 56,2 bzw. 18,4% [23].
- Ethische Aspekte: Die Entscheidung, ob ein Patient mit einer schweren, fibrosierenden ILD intubiert werden und oder eine ECMO zum Einsatz kommen soll, ist ethisch schwierig und sollte mit den Patienten und den Angehörigen ausführlich thematisiert werden. In den meisten Fällen wird hiervon Abstand genommen.
Prävention
- Impfungen gegen Influenza und Pneumokokken können möglicherweise eine akute Exazerbation der idiopathischen Lungenfibrose verhindern und werden daher generell empfohlen.
- Analysen der INPULSIS-Studien haben gezeigt, dass der Einsatz von Nintedanib die Zeit bis zur ersten akuten Exazerbation verlängert und dies insbesondere bei solchen Patienten, bei denen eine fortgeschrittene Erkrankung, d.h. FVC<70%, vorliegt [19]. Insbesondere die Rate der schwergradig verlaufenden AE-IPF, die zu einem Krankenhaus- und damit potenziell zu einem Intensivaufenthalt führen, kann signifikant reduziert werden. Für Pirfenidon lässt sich diesbezüglich noch keine eindeutige Aussage treffen, insbesondere, weil AE-IPF in den CAPACITY- und ASCEND-Studien kein Studienendpunkt war [13].
Literatur
Quellenangaben
-
[1] Akira M, Kozuka T, Yamamoto S et al. Computed tomography findings in acute exacerbation of idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2008; 178: 372–378
Suche in: PubMed Google Scholar
-
[2] Antoniou KM, Wells AU. Acute exacerbations of idiopathic pulmonary fibrosis. Respiration 2013; 86: 265–274
Suche in: PubMed Google Scholar
-
[3] Behr J, Günther A, Ammenwerth W. S2K-Leitlinie zur Diagnostik und Therapie der idiopathischen Lungenfibrose. Pneumologie 2013; 67: 81–111
Suche in: PubMed Google Scholar
-
[4] Boyer A, Vargas F, Delacre M et al. Prognostic impact of high-flow nasal cannula oxygen supply in an ICU patient with pulmonary fibrosis complicated by acute respiratory failure. Intensive Care Med 2011; 7: 558–559
Suche in: PubMed Google Scholar
-
[5] Collard HR, Ryerson CJ, Corte TJ et al. Acute exacerbation of idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2016; 194: 265–275
Suche in: PubMed Google Scholar
-
[6] Collard HR, Richeldi L, Kim DS et al. Acute exacerbations in the INPULSIS trials of nintedanib in idiopathic pulmonary fibrosis. Eur Respir J. 2017; 49: 1601339
Suche in: PubMed Google Scholar
-
[7] Fernández-Pérez ER, Yilmaz M, Jenad H et al. Ventilator settings and outcome of respiratory failure in chronic interstitial lung disease. Chest 2008; 133: 1113–1119
Suche in: PubMed Google Scholar
-
[8] Inase N, Sawada M, Ohtani Y et al. Cyclosporin A followed by the treatment of acute exacerbation of idiopathic pulmonary fibrosis with corticosteroid. Intern Med 2003; 42: 565–570
Suche in: PubMed Google Scholar
-
[9] Isshiki T, Sakamoto S, Kinoshita A et al. Recombinant human soluble thrombomodulin treatment for acute exacerbation of idiopathic pulmonary fibrosis: a retrospective study. Respiration 2015; 89: 201–207
Suche in: PubMed Google Scholar
-
[10] Itai J, Ohshimo S, Kida Y et al. A pilot study: a combined therapy using polymyxin-B hemoperfusion and extracorporeal membrane oxygenation for acute exacerbation of interstitial pneumonia. Sarcoidosis Vasculitis and Diffuse Lung Disease 2015; 31: 343–349
Suche in: PubMed Google Scholar
-
[11] Juarezmm, Chan AL, Norris AG. et al. Acute exacerbation of idiopathic pulmonary fibrosis – a review of current and novel pharmacotherapies. J Thorac Disease 2015; 7: 499–519
Suche in: PubMed Google Scholar
-
[12] Kawamura K, Ichikado K, Yasuda Y et al. Azithromycin for idiopathic acute exacerbation of idiopathic pulmonary fibrosis: a retrospective single-center study. BMC Pulm Med. 2017; 17: 94
Suche in: PubMed Google Scholar
-
[13] King TE, Bradford WZ, Castro-Bernardini S et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 2014; 370: 2083–2092
Suche in: PubMed Google Scholar
-
[14] Kreuter M, Bendstrup E, Russell AM et al. Palliative care in interstitial lung disease: living well. Lancet Respir Med 2017 Oct 12 [Epub ahead of print]
Suche in: PubMed Google Scholar
-
[15] Ley B, Swigris J, Day BM et al. Pirfenidone reduces respiratory-related hospitalizations in Idiopathic Pulmonary Fibrosis. Am J Respir Crit Care Med 2017; 196: 756–761
Suche in: PubMed Google Scholar
-
[16] Morawiec E, Tillie-Leblond I, Pansini V et al. Exacerbations of idiopathic pulmonary fibrosis treated with corticosteroids and cyclophosphamide pulses. Eur Respir J 2011; 38: 1487–1489
Suche in: PubMed Google Scholar
-
[17] Raghu G, Collard HR, Egan J. et al. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med 2011; 183: 788–824
Suche in: PubMed Google Scholar
-
[18] Raghu G, Anstrom KJ, King TE Jr et al. Prednisone, azathioprine, and N-acetylcysteine for pulmonary fibrosis. N Engl J Med. 2012; 366: 1968–1977
Suche in: PubMed Google Scholar
-
[19] Richeldi L, du Bois RM, Raghu G et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 2014 May 29; 370(22): 2071–2082
Suche in: PubMed Google Scholar
-
[20] Richeldi L, Cottin V, du Bois RM et al. Nintedanib in patients with idiopathic pulmonary fibrosis: Combined evidence from the TOMORROW and INPULSIS® trials. Respir Med 2016; 113: 74–79
Suche in: PubMed Google Scholar
-
[21] Rush B, Wiskar K, Berger L, Griesdale D. The use of mechanical ventilation in patients with idiopathic pulmonary fibrosis in the United States: A nationwide retrospective cohort analysis. Respir Med 2016; 111: 72–76
-
[22] Ryerson CJ, Cottin V, Brown KK et al. Acute exacerbation of idiopathic pulmonary fibrosis: shifting the paradigm. Eur Respir J 2015; 46: 512–520
Suche in: PubMed Google Scholar
-
[23] Song JW, Hong SB, Limcm et al. Acute exacerbation of idiopathic pulmonary fibrosis: incidence, risk factors and outcome. Eur Respir J 2011 37: 356–363
Suche in: PubMed Google Scholar
-
[24] Travis WD, Costabel U, Hansell DM et al. An official American Thoracic Society/European Respiratory Society statement: update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am J Respir Crit Care Med 2013; 188: 733–748
Suche in: PubMed Google Scholar
-
[25] Dhanani Z, Gupta R. The Management of Interstitial Lung Disease in the ICU: A Comprehensive Review. J Clin Med. 2024 Nov 6;13(22):6657.
Suche in: PubMed Google Scholar - [26] Pagliaro R, Aronne L, Fomez R et al. High-Flow Nasal Cannula System in Respiratory Failure Associated with Interstitial Lung Diseases: A Systematic Review and Narrative Synthesis. J Clin Med. 2024 May 17;13(10):2956.
Suche in: PubMed Google Scholar
- [27] Behr J, Bonella F, Frye BC, Günther A, Hagmeyer L, Henes J, Klemm P, Koschel D, Kreuter M, Leuschner G, Nowak D, Prasse A, Quadder B, Sitter H, Costabel U. S2k-Leitlinie Pharmakotherapie der idiopathischen Lungenfibrose (ein Update) und anderer progredienter pulmonaler Fibrosen. https://register.awmf.org/de/leitlinien/detail/020-025 2022.
- [28] Kreuter M, Behr J, Bonella F, Costabel,.U, Gerber A, Hamer OW, Heussel CP, Jonigk D, Krause A, Koschel D, Leuschner G,, Markart P, Nowak D, Pfeifer M, Prasse A, Wälscher J, Winter H, Kabitz HJ. S1 Leitlinie Interdisziplinäre Diagnostik interstitieller Lungenerkrankungen im Erwachsenenalter. https://register.awmf.org/de/leitlinien/detail/020-028 2023.
Wichtige Internetadressen
Herausgeber*innen, Autor*innen und Aktualisierung
Herausgeber*innen: Gernot Marx, Kai Zacharowski, Stefan Kluge
Autor*innen: Bernd Schönhofer, Michael Kreuter