Interstitielle Lungenerkrankungen
Innere Medizin
| Synonym Diffuse Parenchymerkrankungen der Lunge (DPLD) |
| Definition Disseminierte Erkrankungen des Lungenbindegewebes mit Tendenz zur Fibrosierung ohne infektiöse Ursache nennt man interstitielle Lungenkrankheiten (ILD). |
Tab. 27.10 gibt einen Überblick über die nicht infektiösen Erkrankungen des Lungenparenchyms.
|
|
|
|
|
ILD durch inhalative Noxen
Exogen-allergische Alveolitis
| Synonym Hypersensitivitätspneumonitis |
| Definition Als exogen-allergische Alveolitis (EAA) wird die hyperergische Reaktion des Lungenparenchyms auf inhalative organische Stäube (und selten Chemikalien) bezeichnet. |
Epidemiologie
Die Prävalenz in der Gesamtbevölkerung liegt bei etwa 4/100 000 Einwohner*innen. Unter Beschäftigten in der Landwirtschaft steigt die Prävalenz auf 85/100 000, in der Vogelzucht auf 150/100 000. Die meisten Fälle der EAA sind Berufserkrankungen (BeKV-Nr. 4 201).
Ätiologie
Die EAA wird durch die Inhalation sehr kleiner organischer Staubpartikel (1–3 µm Durchmesser) ausgelöst, die sich im Alveolarraum ablagern. Häufigste Formen sind die Farmerlunge und die Vogelhalterlunge (Tab. 27.11).
Pathogenese
Es kommt zur Immunreaktion Typ Arthus (Immunkomplexkrankheit) im Alveolarbereich mit Bildung von antigenspezifischen IgG-Immunkomplexen. Eine wiederholte Antigenexposition führt zur chronischen interstitiellen Entzündung mit Aktivierung von Neutrophilen, später von CD8-Lymphozyten. Es können sich entzündliche Granulome bilden. Gestörte Reparaturmechanismen führen schließlich zu einer disseminierten Narbenbildung, d. h. zur Lungenfibrose.
Klinik
Die Symptome der akuten Form der EAA beginnen etwa 6–8 Stunden nach Exposition mit Fieber, Frösteln, Kopfschmerzen, Krankheitsgefühl, Thoraxdruck und Belastungsdyspnoe. Sie verschwinden spontan innerhalb von 2 Tagen. Die chronische Form der EAA beginnt schleichend mit trockenem Husten, Belastungsdyspnoe, Müdigkeit und Gewichtsverlust (pulmonale Kachexie).
Diagnostik
Die genaue Erhebung der Anamnese liefert wichtige Hinweise auf die Antigenexposition (Berufsanamnese!). Bei der Auskultation hört man ein feines endinspiratorisches Knisterrasseln (velcro rales). Der serologische Nachweis von präzipitierenden Antikörpern gegen das verdächtige Antigen spricht für eine stattgefundene Exposition.
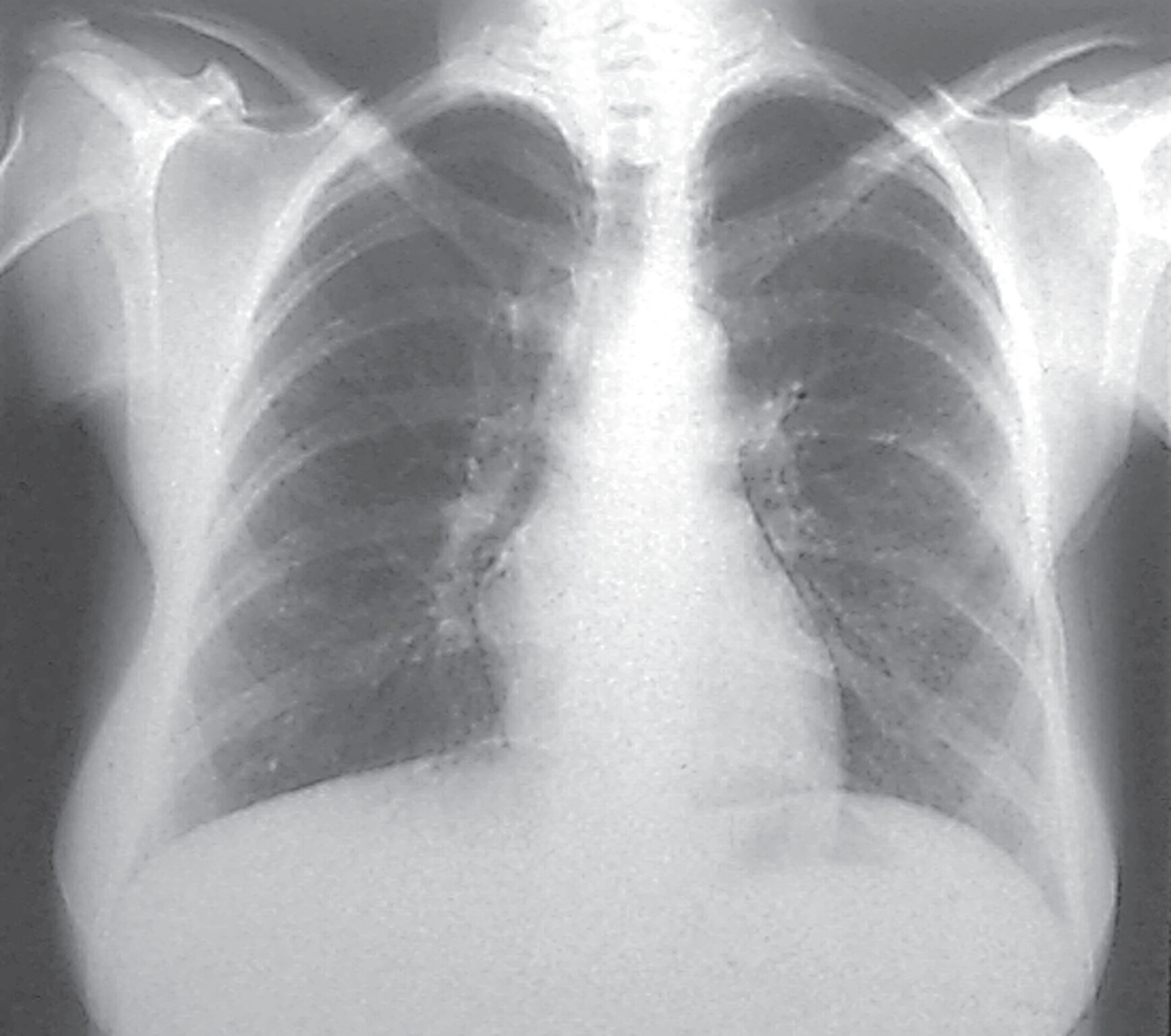
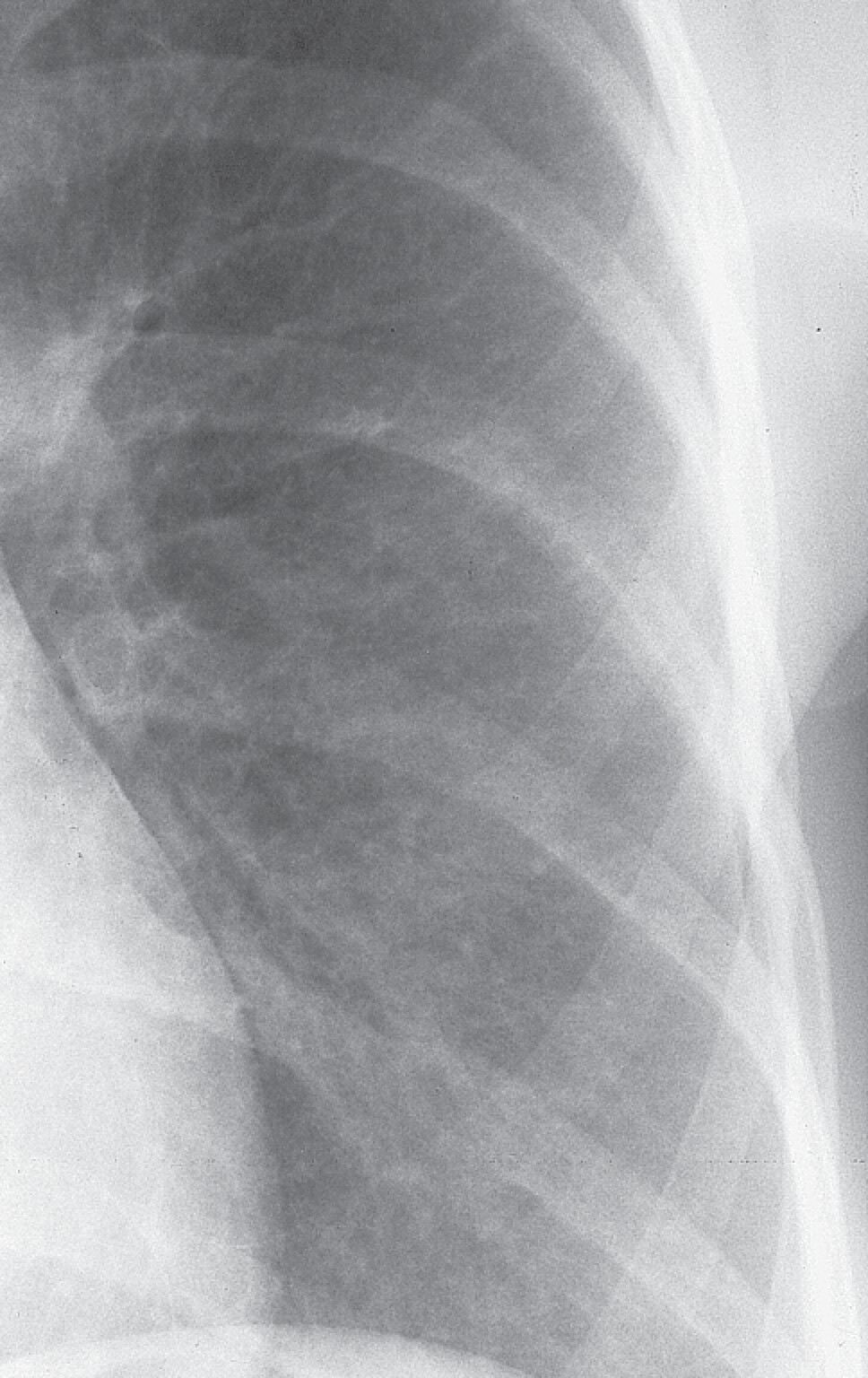
In der Lungenfunktionsanalyse zeigt sich eine restriktive Ventilationsstörung mit kleiner TLC (totale Lungenkapazität) und Behinderung des CO-Transfers (Diffusionsstörung). In Ruhe kann die Blutgasanalyse normal ausfallen, unter leichter Belastung (40 Watt) jedoch entwickelt sich eine Hypoxämie. Das HR-CT kann bereits frühe Stadien der EAA nachweisen (disseminierte Milchglastrübungen, Retikulationen, Fibrose), die in der Röntgen-Thorax-Übersicht oft schwer zu erkennen sind. In der Röntgen-Thorax-Übersicht in 2 Ebenen findet sich eine disseminierte, feinfleckige, manchmal feinretikuläre Zeichnungsvermehrung über allen Lungenabschnitten (Abb. 27.5). Für die Diagnostik ist das HR-CT, wie bei allen interstitiellen Lungenerkrankungen essenziell. Die akute EAA zeigt dabei ein relativ typisches Muster mit großflächigem Milchglas und häufig ein sogenanntes Mosaikmuster. Die chronische EAA zeigt dagegen unterschiedliche radiologische Muster, sodass die Diagnose sich oft schwierig gestaltet.
 © Pfeifer M. Nicht infektiöse Erkrankungen des Lungenparenchyms (= interstitielle Lungenerkrankungen, ILD). In: Arastéh K, Baenkler H, Bieber C, Boesecke C, Brandt R, Bruns B, Bugaj T, Chatterjee T, Ditting T et al., Hrsg. Duale Reihe Innere Medizin. 5., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b000000592
© Pfeifer M. Nicht infektiöse Erkrankungen des Lungenparenchyms (= interstitielle Lungenerkrankungen, ILD). In: Arastéh K, Baenkler H, Bieber C, Boesecke C, Brandt R, Bruns B, Bugaj T, Chatterjee T, Ditting T et al., Hrsg. Duale Reihe Innere Medizin. 5., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b000000592
 © Pfeifer M. Nicht infektiöse Erkrankungen des Lungenparenchyms (= interstitielle Lungenerkrankungen, ILD). In: Arastéh K, Baenkler H, Bieber C, Boesecke C, Brandt R, Bruns B, Bugaj T, Chatterjee T, Ditting T et al., Hrsg. Duale Reihe Innere Medizin. 5., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b000000592
© Pfeifer M. Nicht infektiöse Erkrankungen des Lungenparenchyms (= interstitielle Lungenerkrankungen, ILD). In: Arastéh K, Baenkler H, Bieber C, Boesecke C, Brandt R, Bruns B, Bugaj T, Chatterjee T, Ditting T et al., Hrsg. Duale Reihe Innere Medizin. 5., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b000000592
Abb. 27.5 Röntgen-Thorax-Übersicht bei exogen-allergischer Alveolitis
Disseminierte kleinfleckig-retikuläre Lungenzeichnung.
a Übersichtsaufnahme.
b Detailaufnahme linkes Unter- und Mittelfeld.
Bei der bronchoalveolären Lavage (BAL) ist die Gesamtzellzahl stark erhöht. Direkt nach Exposition sind die Neutrophilen vermehrt, später findet man eine erhebliche Lymphozytose (30–50%) mit einem Anstieg der CD8-Zellen.
Eine Lungenbiopsie ist nur zur differenzialdiagnostischen Abklärung notwendig, vor allem bei der chronischen Verlaufsform.
Um die Auslösung der akuten EAA durch bestimmte (z. B. berufliche) Stoffe endgültig nachzuweisen, kann man das native Antigen inhalieren lassen (inhalative Provokation). Unter Klinikbedingungen beobachtet man in den nächsten 48 Stunden die Entwicklung eines alveolitischen Schubes mit Fieber, trockenem Husten, Atemnot, Leukozytose, Lungenfunktionsverschlechterung, Hypoxämie.
Differenzialdiagnose
Die massive Exposition von Getreidestaub kann ein grippeähnliches Syndrom verursachen, das oft mit der EAA verwechselt wird: das OTDS (organic toxic dust syndrome, Drescherfieber). Einige Stunden nach Exposition kommt es zu Fieber, thorakaler Enge, Belastungsdyspnoe und trockenem Husten. Innerhalb von 24 Stunden klingen alle Symptome wieder ab. Es entwickeln sich nie Antikörperkomplexe und kein bleibender Lungenschaden. Die chronische Form der EAA ist schwer von einer idiopathischen Lungenfibrose zu unterscheiden, wenn keine Präzipitine nachweisbar sind.
Therapie
Wie bei jeder hyperergischen Reaktion ist die Expositionsprophylaxe mit Antigenkarenz (u. U. Berufswechsel) essenziell. Ihre Effizienz kann am Abfall der Präzipitin-Titer, aber auch am Abklingen der Beschwerden beobachtet werden. Zumindest die akute EAA spricht gut auf orale Kortikosteroide an (0,5 mg Prednison /kg KG/Tag für 4–6 Wochen, anschließend ausschleichen).
Prognose
Die Prognose der akuten EAA ist bei konsequenter Antigenkarenz generell gut. Die chronische EAA kann trotz Therapie progredient verlaufen und infolge einer respiratorischen Insuffizienz oder eines Rechtsherzversagens auch tödlich enden.
Pneumokoniosen
| Definition Pneumokoniosen sind Lungenparenchymerkrankungen durch anorganische Stäube, vor allem Quarzstäube (Staublunge, Bergmannslunge). Es handelt sich um Berufserkrankungen, die bei der Bearbeitung von Gestein auftreten. Die wichtigste Form ist die Silikose (BKV-Nummer 4 101), die in Deutschland selten geworden ist (im Jahr 2005 nur noch 1 011 Silikosen bei insgesamt 5 168 Pneumokoniosen). |
Asbestose
Asbest verursacht vier Krankheiten: Die Pleuraasbestose ist die häufigste Manifestationsform einer durch Asbest verursachten Erkrankung. Die Lungenasbestose (d. h. die interstitielle Lungenkrankheit) ist extrem selten, ebenso selten ist das durch Asbest verursachte Bronchialkarzinom, selten das Mesotheliom.
Silikose
Ätiologie
Eine Silikose entsteht durch die Inhalation von alveolengängigen Quarzstäuben (Kieselsäure; SiO2) z. B. im Bergbau, bei Mineuren, in Gießereien, in der keramischen Industrie, bei Arbeiten mit Sandstrahlern.
Pathogenese
Die Quarzstäube werden im Alveolarraum von Makrophagen aufgenommen, können aber von diesen nicht abgebaut werden. Es bildet sich eine interstitielle Entzündung mit lokaler Fibrogenese aus. Im Lungeninterstitium entstehen Silikoseknötchen mit hyaliner Degeneration. Diese Knötchen können zu großflächigen Schwielen konfluieren und aufgrund ihrer Schrumpfungstendenz ein perifokales Emphysem ausbilden. Die Hilus- und Mediastinallymphknoten können „abgeschwemmtes“ silikotisches Material aufnehmen und Verkalkungen der Randsinus bilden (sog. Eierschalen-Lymphknoten).
Klinik
Eine beginnende Silikose verursacht keine Symptome. Sie ist nur durch arbeitsmedizinische Vorsorgeuntersuchung zu erkennen. Später dominieren die Symptome der chronischen obstruktiven Atemwegserkrankung, d. h. Husten, Auswurf, Belastungsdyspnoe. Eine ausgeprägte Lungenparenchymbeteiligung führt zur Belastungsdyspnoe und letztlich zur Ruhedyspnoe. In der Folge steigt der pulmonalarterielle Druck, es entwickelt sich ein Cor pulmonale.
Komplikationen
Es kann sich eine schwere Verlaufsform der Lungentuberkulose entwickeln, die heute aber selten ist (Silikotuberkulose; BKV-Nr. 4 102). Das Caplan-Syndrom ist das gemeinsame Auftreten von Lungensilikose und rheumatoider Arthritis. Dabei entstehen Lungenrundherde (bis 2 cm Durchmesser). Silikosepatient*innen (v. a. bei Tabakrauchkonsum) haben außerdem eine höhere Inzidenz für Bronchialkarzinome (BKV-Nr. 4 112).
Diagnostik
Die zentrale Rolle in der Diagnostik haben Berufsanamnese und die Röntgen-Thorax-Übersicht (Abb. 27.6), die nach standardisierten Kriterien beurteilt wird (ILO-Klassifikation der International Labor Organization). Das HR-CT ist deutlich sensitiver. Funktionsanalytisch besteht meist eine obstruktive Ventilationsstörung und individuell sehr unterschiedlich entweder eine Lungenüberblähung (Vergrößerung des Residualvolumens im Sinne einer COPD) oder eine restriktive Ventilationsstörung (im Sinne der ILD). Unter leichter körperlicher Belastung (40 Watt) wird die Gasaustauschstörung deutlich sichtbar. In Zweifelsfällen empfiehlt sich eine chirurgische Lungenbiopsie.
 © Pfeifer M. Nicht infektiöse Erkrankungen des Lungenparenchyms (= interstitielle Lungenerkrankungen, ILD). In: Arastéh K, Baenkler H, Bieber C, Boesecke C, Brandt R, Bruns B, Bugaj T, Chatterjee T, Ditting T et al., Hrsg. Duale Reihe Innere Medizin. 5., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b000000592
© Pfeifer M. Nicht infektiöse Erkrankungen des Lungenparenchyms (= interstitielle Lungenerkrankungen, ILD). In: Arastéh K, Baenkler H, Bieber C, Boesecke C, Brandt R, Bruns B, Bugaj T, Chatterjee T, Ditting T et al., Hrsg. Duale Reihe Innere Medizin. 5., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b000000592
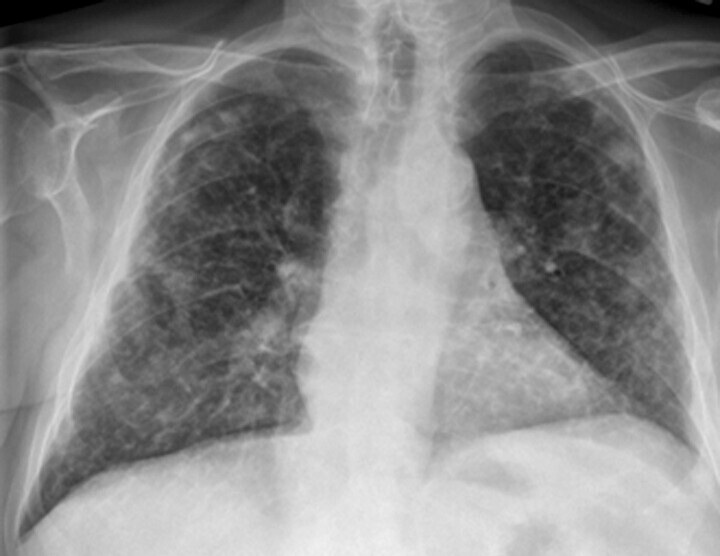
Abb. 27.6 Silikose in der Röntgen-Thorax-Übersicht
Röntgen-Thorax-Übersicht p.–a.: Es kommen disseminierte, unterschiedlich große, relativ scharf begrenzte Fleckschatten in beiden Lungen zur Darstellung. Die Pleura ist abschnittsweise verbreitert.
(Quelle: Krombach G. Lunge und Pleura. In: Krombach G, Mahnken A, Hrsg. Radiologische Diagnostik Abdomen und Thorax. Stuttgart: Thieme; 2015)
Therapie
Entscheidend ist die konsequente Expositionsprophylaxe schon bei begründeten Verdachtsfällen. Man kann die begleitende COPD behandeln, nicht jedoch die Restriktion (Fibrosierung) durch die Lungenparenchymerkrankung. Eine Sauerstoff-Langzeittherapie (mehr als 18 Stunden tägl.) hemmt die Progression des Cor pulmonale.
Prognose
Durch die arbeitsmedizinische Vorsorge werden in Deutschland Silikosen sehr früh erkannt und sind meist ohne Einfluss auf Lebensqualität oder Lebenserwartung.
Toxische Lungenerkrankungen
| Definition Verschiedene inhalative und nicht inhalative Schadstoffe führen auf toxischem Wege zum Lungenschaden und zu einer ILD. |
Ätiologie
Inhalative Noxen sind z. B. Nitrosegase, Chlorgas, Schwefeldioxid, Metalldämpfe, Haarsprays, Ledersprays. Enteral oder parenteral aufgenommene Noxen sind meist Medikamente, z. B. Amiodarone, Bleomycin, Nitrofurantoin, Methotrexat, Goldsalze.
Pathogenese
Die verschiedenen Noxen führen zu den unterschiedlichsten Reaktionsformen des Lungenparenchyms. Man findet akute Alveolarschäden, Alveolitiden (lymphozytär, neutrophil oder eosinophil) mit mehr oder weniger Fibrogenese sowie obliterierende Bronchiolitiden.
Klinik
Inhalative Noxen führen meist innerhalb weniger Stunden, nicht inhalative in Tagen bis Wochen zu Belastungs- bis Ruhedyspnoe mit akuter respiratorischer Insuffizienz.
Diagnostik
Entscheidend sind die Anamnese und die Identifizierung der Noxe. Eine bronchoalveoläre Lavage mit entzündlichen Zellbildern und eine HR-CT mit interstitieller Zeichnungsvermehrung können bereits zur Sicherung der Diagnose ausreichen. In Zweifelsfällen wird eine transbronchiale Lungenbiopsie erforderlich. Lungenfunktionsanalyse und Blutgasanalyse dienen der Erfassung der Funktionsstörung.
Therapie
Die Noxe muss eliminiert werden, das genügt in vielen Fällen zur kompletten Sanierung. Andernfalls sollte eine orale Kortikosteroidtherapie begonnen werden.
Internet-Link
ILD durch nicht inhalative Noxen
Lungenerkrankungen durch Medikamente
ILD können unter der Einnahme einer Vielzahl von Medikamenten auftreten, z. B. häufig Zytostatika (z. B. Bleomycin, Nitrosoharnstoffe, Cyclophosphamid; meist dosisabhängig), seltener andere Substanzgruppen wie z. B. Analgetika, Antibiotika, Antiarrhythmika, Statine (aktuelle Liste unter www.pneumotox.com). Daher spielt die Medikamentenanamnese bei der Diagnostik einer neu aufgetretenen ILD eine entscheidende Rolle.
Strahlenpneumonitis
Ionisierende Strahlen wirken lungenschädigend; ab einer Strahlendosis von 30 Gy kann damit gerechnet werden. Deshalb wird bei der Strahlentherapie versucht, durch eine 3-D-konforme Bestrahlung und geringe Sicherheitssäume (involved field radiatio) möglichst wenig Lungengewebe zu schädigen. Der akute Alveolar- und Endothelschaden heilt mit Narbenbildung ab.
ILD in Verbindung mit Systemerkrankungen
Kollagenosen
Ätiologie
Alle Kollagenosen können mit einer Lungenbeteiligung einhergehen (ca. 30–50% aller Fälle). Dabei treten ILD und andere Erkrankungen auf (Tab. 27.12).
Diagnostik
Wenn die Diagnose der Kollagenose schon feststeht, müssen lediglich Differenzialdiagnosen (s. Tab. 27.12) ausgeschlossen werden. Dazu genügen meist eine thorakale CT und eine bronchoalveoläre Lavage.
Therapie
Meist reicht die Therapie der Grundkrankheit (Kollagenose) aus.
|
|
|
systemischer Lupus erythematodes (SLE) |
|
|
|
|
Dermatomyositis/Polymyositis/Anti-Synthetase-Syndrom |
|
Vaskulitiden
Prinzipiell findet man Lungenbeteiligungen bei allen Vaskulitiden, jedoch in stark unterschiedlicher Häufigkeit. Bei den ANCA-assoziierten Kleingefäßvaskulitiden sind Lungenerkrankungen die Regel. Die nachfolgenden Krankheitsbilder beinhalten nur die pneumologischen Manifestationen. Weitere Informationen finden sich in den entsprechenden Kapiteln.
Granulomatose mit Polyangiitis: Man findet eine granulomatös-nekrotisierende Rhinitis und Sinusitis, eine ulzerierende Tracheobronchitis, einschmelzende Lungenrundherde. Die Lungenherde verursachen Hämoptysen. Interstitielle Lungenveränderungen kommen selten vor.
Mikroskopische Polyangiitis: Sie ist durch eine lebensbedrohlich verlaufende profuse Lungenblutung kompliziert, die eine rasche Diagnostik und Therapie erforderlich macht. Eine langsam verlaufende interstitielle Lungenerkrankung kommt vor.
Eosinophile Granulomatose mit Polyangiitis: Diese Erkrankung kann sich äußern durch Rhinitis mit Polyposis, schwer einstellbarem Asthma bronchiale und wechselhafte „pneumonische“ Lungeninfiltrate (eosinophile interstitielle Infiltrate), s. Tab. 27.13.
Sarkoidose
| Sysnonym Morbus Boeck (sprich: „Boog“) |
| Definition Die Sarkoidose ist eine granulomatöse Multisystemerkrankung mit häufiger Lungenbeteiligung. |
Epidemiologie
Die Prävalenz beträgt in Mitteleuropa ca. 40/100 000 Einwohner*innen und nimmt von Nord nach Süd ab. Der Altersgipfel der Erstmanifestation liegt zwischen dem 20. und 40. Lebensjahr.
Ätiologie
Die jahrzehntelange Suche nach einem pathogenen Agens war bisher erfolglos. Eine neuere Hypothese geht von einer speziellen individuellen Körperabwehrreaktion auf ubiquitäre Antigene aus. Dabei gibt es familiäre Häufungen.
Pathogenese
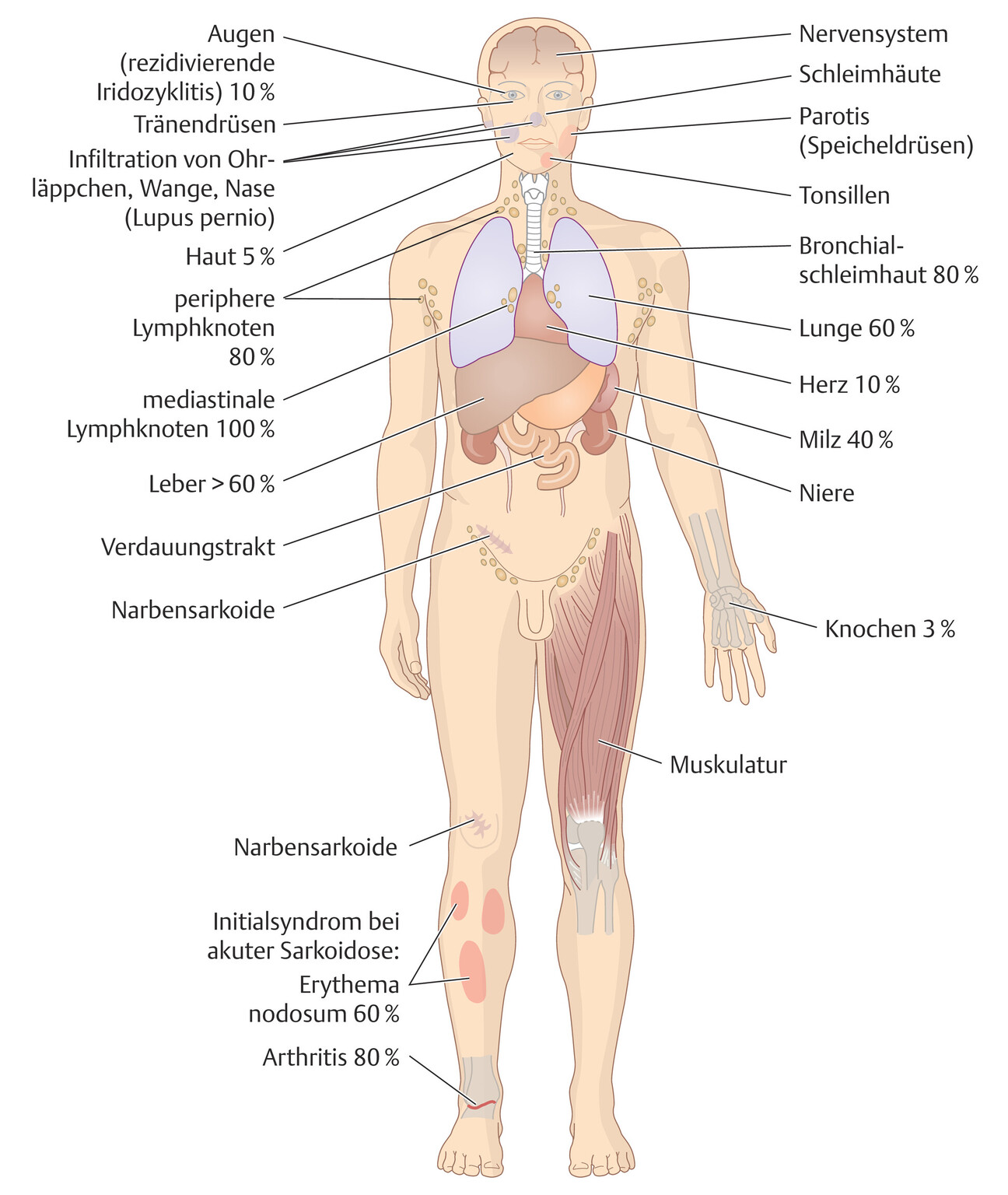
Es entwickeln sich disseminierte, nicht verkäsende epitheloidzellige Granulome mit Riesenzellen vom Langhans-Typ, die in allen Organen auftreten können (Abb. 27.7). Diese können hyalin degenerieren und mit oder ohne Narbenbildung abheilen. Als immunologische Begleitreaktion kommen bei akuten Formen eine Arthritis und ein Erythema nodosum vor.
Abb. 27.7 Manifestationsorte der Sarkoidose
Klinik
Bei der Lungensarkoidose unterscheidet man zwei Verlaufsformen:
- Akute Sarkoidose (5%): Sie beginnt meist als Löfgren-Syndrom mit Fieber, schwerem Krankheitsgefühl, Erythema nodosum (meist an den Beinen) und Arthritis (meist der Sprunggelenke). Dazu gehört der Röntgen-Thorax-Befund einer Hiluslymphknotenschwellung (Adenopathie) beidseits.
- Chronische Sarkoidose (95%): Sie macht sich schleichend mit Belastungsdyspnoe und trockenem Reizhusten bemerkbar und wird oft zufällig bei einer Röntgenuntersuchung entdeckt.
Diagnostik
Besteht der Verdacht einer Sarkoidose, sollte eine Röntgen-Thorax-Übersicht durchgeführt werden. Die Lungensarkoidose kann nach dem Röntgen-Thorax-Befund in vier Röntgentypen eingeteilt werden (Abb. 27.8):
- Typ I: beidseitige Hilusadenopathie ohne pulmonale Beteiligungen
- Typ II: beidseitige Hilusadenopathie mit pulmonalen Beteiligungen
- Typ III: pulmonale Beteiligungen ohne Hilusadenopathie
- Typ IV: Zeichen der Lungenfibrose.
Bei Erkrankungen vom Typ I können bei 70–90% der Fälle innerhalb eines Jahres spontane Remissionen erwartet werden, vor allem, wenn ein Löfgren-Syndrom vorliegt (akute Sarkoidose). Beim Typ II findet man immerhin noch 50% Spontanremissionen.
 © Pfeifer M. Nicht infektiöse Erkrankungen des Lungenparenchyms (= interstitielle Lungenerkrankungen, ILD). In: Arastéh K, Baenkler H, Bieber C, Boesecke C, Brandt R, Bruns B, Bugaj T, Chatterjee T, Ditting T et al., Hrsg. Duale Reihe Innere Medizin. 5., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b000000592
© Pfeifer M. Nicht infektiöse Erkrankungen des Lungenparenchyms (= interstitielle Lungenerkrankungen, ILD). In: Arastéh K, Baenkler H, Bieber C, Boesecke C, Brandt R, Bruns B, Bugaj T, Chatterjee T, Ditting T et al., Hrsg. Duale Reihe Innere Medizin. 5., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b000000592
 © Pfeifer M. Nicht infektiöse Erkrankungen des Lungenparenchyms (= interstitielle Lungenerkrankungen, ILD). In: Arastéh K, Baenkler H, Bieber C, Boesecke C, Brandt R, Bruns B, Bugaj T, Chatterjee T, Ditting T et al., Hrsg. Duale Reihe Innere Medizin. 5., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b000000592
© Pfeifer M. Nicht infektiöse Erkrankungen des Lungenparenchyms (= interstitielle Lungenerkrankungen, ILD). In: Arastéh K, Baenkler H, Bieber C, Boesecke C, Brandt R, Bruns B, Bugaj T, Chatterjee T, Ditting T et al., Hrsg. Duale Reihe Innere Medizin. 5., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b000000592
 © Pfeifer M. Nicht infektiöse Erkrankungen des Lungenparenchyms (= interstitielle Lungenerkrankungen, ILD). In: Arastéh K, Baenkler H, Bieber C, Boesecke C, Brandt R, Bruns B, Bugaj T, Chatterjee T, Ditting T et al., Hrsg. Duale Reihe Innere Medizin. 5., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b000000592
© Pfeifer M. Nicht infektiöse Erkrankungen des Lungenparenchyms (= interstitielle Lungenerkrankungen, ILD). In: Arastéh K, Baenkler H, Bieber C, Boesecke C, Brandt R, Bruns B, Bugaj T, Chatterjee T, Ditting T et al., Hrsg. Duale Reihe Innere Medizin. 5., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b000000592
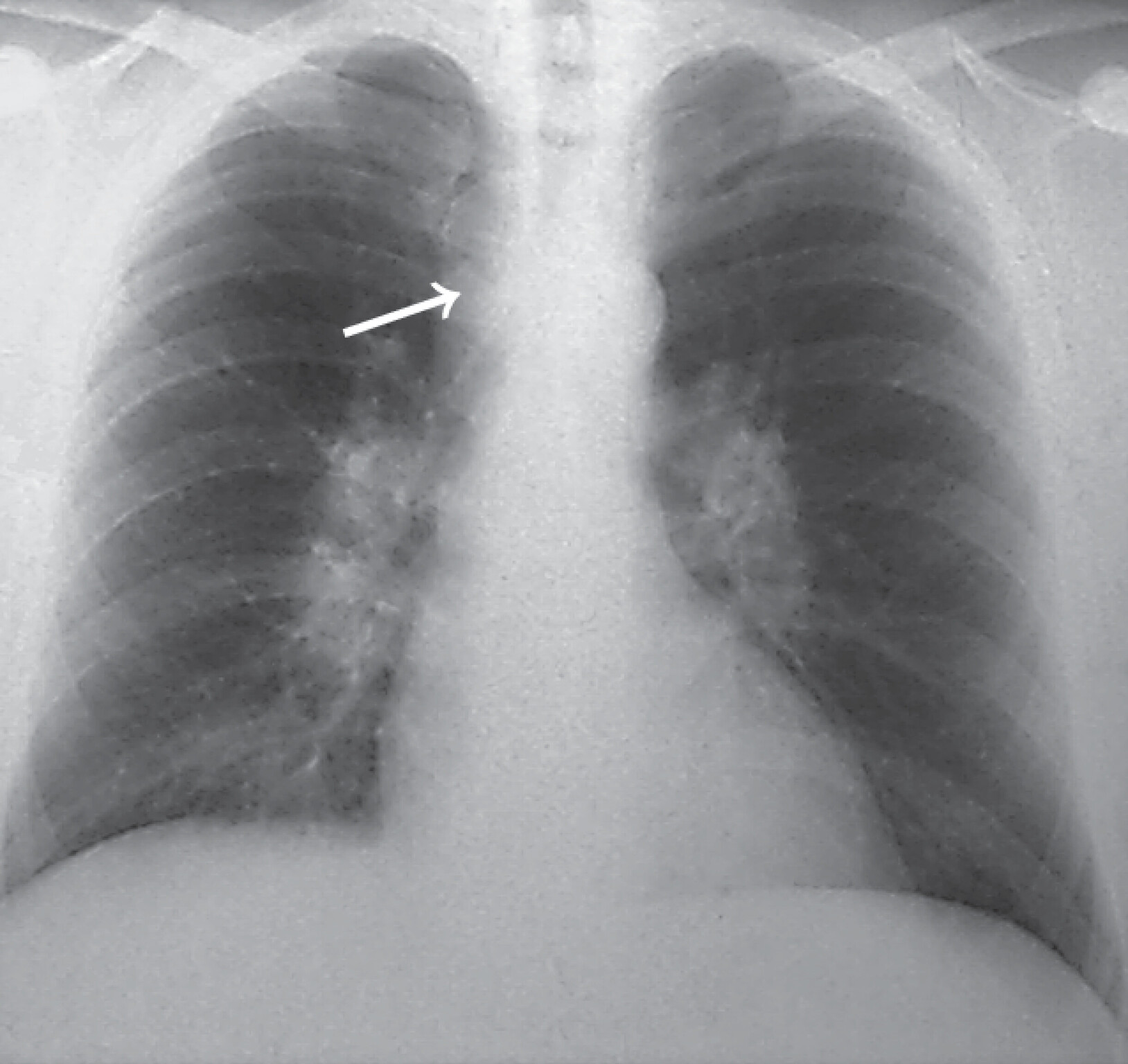
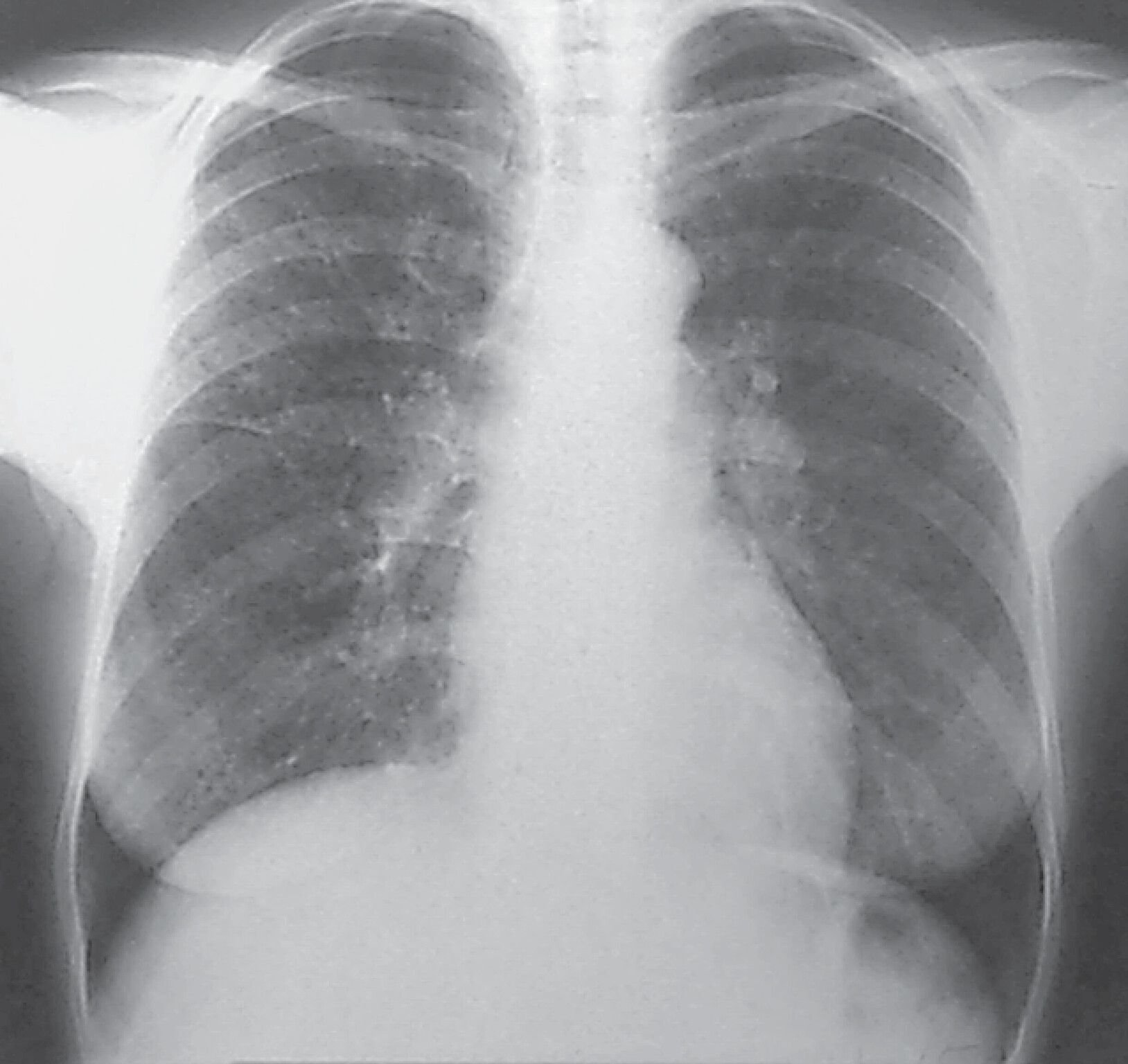
Abb. 27.8 Sarkoidose
a Akute Sarkoidose Röntgentyp I. 38-jähriger Mann mit Reizhusten und beidseitiger Sprunggelenksarthritis. Röntgenologisch beidseitige Hiluslymphome, mäßige Verbreiterung des Mediastinums im rechten Tracheobronchialwinkel nach rechts durch Mediastinallymphome (→). Rückbildung der Gelenkbeschwerden nach 2-wöchiger Diclofenac-Therapie.
b Chronische Sarkoidose Röntgentyp II. 47-jährige Frau. Disseminierte kleinfleckig-streifige, z. T. konfluierende Konsolidierungen beider Lungen, geringe Hiluslymphome beidseits. Die Patientin ist symptomfrei.
c Chronische Sarkoidose Röntgentyp IV. 37-jährige Frau. Dichte beidseitige grobfleckig-streifige z. T. konfluierende Lungenverschattungen mit unscharfer Abgrenzung der Zwerchfelle, geringe Verdichtung und Kranialverziehung der Hili beiderseits. Die Patientin wurde durch Belastungsdyspnoe auffällig.
In der Lungenfunktionsanalyse kann beim chronischen Verlauf vom Normalbefund bis zur schweren restriktiven Ventilationsstörung mit Diffusionshindernis alles gefunden werden. In fortgeschrittenen Fällen sieht man oft eine begleitende obstruktive Ventilationsstörung.
Zur Sicherung der Diagnose sollte ein histologischer Nachweis der nicht verkäsenden epitheloidzelligen Granulome erfolgen (DD zur Tuberkulose!). Dazu eignet sich die EBUS-TBNA der mediastinalen Lymphknoten und/oder die transbronchiale Lungenbiopsie.
Die bronchoalveoläre Lavage zeigt das Bild einer lymphozytären Alveolitis: Erhöhung der Gesamtzellzahl vor allem durch Lymphozyten (vorwiegend CD4-Zellen) mit entsprechend erhöhtem CD4/CD8-Quotienten. Bei einem Quotienten > 3,5 ist eine Sarkoidose wahrscheinlich.
Im Labor zeigen sich u. a. eine Erhöhung der BSG (insbesondere bei akutem Verlauf), der Gammaglobuline (v. a. IgG) und des Kalziums in Blut und Urin. Als Aktivitätsmarker eignen sich: Serum-ACE (Angiotensin-converting enzyme), Serum-Kalzium und Serum-LDH, sowie Neopterin und Interleukin-2-Rezeptor. Der Tuberkulin-Hauttest ist üblicherweise negativ (aufgrund einer Störung der T-Zell-Funktion).
Immer sollte auch an andere Organmanifestationen (Abb. 27.7) gedacht werden, vor allem an ZNS, Herz, Niere, Auge und Gehirn wegen der schwerwiegenden Folgen für diese Organe.
Differenzialdiagnosen
Bei Hilusadenopathie sind immer alle Formen des malignen Lymphoms abzugrenzen. Die pulmonalen Konsolidierungen können mit einer Lungentuberkulose verwechselt werden.
Therapie
Da sich die akute Sarkoidose mit Löfgren-Syndrom meist spontan zurückbildet, beobachtet man den Verlauf und behandelt nur symptomatisch. Bei Schmerzen (Arthritis, Erythema nodosum) können nichtsteroidale Antiphlogistika, Steroide sowie lokale Umschläge verabreicht werden.
Die chronische Sarkoidose wird nur behandelt, wenn Hinweise für eine Krankheitsprogression bestehen oder lebenswichtige extrapulmonale Organe betroffen sind. Indikationen für eine Kortikosteroidtherapie sind:
- Röntgentyp II–IV oder Progression des Röntgentyps und/oder
- Zunahme der Symptome und/oder
- Lungenfunktionseinschränkung oder -verschlimmerung
(ggf. zusammen mit auffälligen Aktivitätsmarkern im Blut) - sowie eine bedrohliche extrapulmonale Manifestation.
Die Kortikosteroidtherapie beginnt mit einer Prednison-Dosis von 0,5 mg/kg KG/d über 4–6 Wochen, die bei Ansprechen der Therapie alle 4–6 Wochen um 5–10 mg reduziert wird. Bei Rezidiven geht man auf die letzte erfolgreiche Dosisstufe zurück. Die Dauer dieser Standardtherapie beträgt meist 6 Monate. Eine Lungensarkoidose spricht meist gut auf diese Therapie an. Rezidive entstehen häufig durch eine voreilige Dosisreduktion. Bei Therapieversagen (selten) kommen Methotrexat, Azathioprin oder TNF-α-Blocker (Infliximab) sowie Rituximab zum Einsatz.
Prognose
Die Prognose der akuten Sarkoidose ist sehr gut. Bei der chronischen Sarkoidose bestimmen die Organschäden den Ausgang. Eine progrediente Lungenfibrose entwickelt sich sehr selten. Die Gesamtletalität der Lungensarkoidose liegt bei 5%. Gleichzeitige Manifestationen an anderen Organen können die Prognose deutlich verschlechtern. So sind Neurosarkoidose und Herzsarkoidose mit einer erhöhten Letalität verbunden.
Pulmonale Langerhans-Zell-Histiozytose
| Definition Die Langerhans-Zell-Histiozytose (früher Histiozytosis X) gehört in die Erkrankungsgruppe der benignen Histiozytosen. Diese Proliferation des Monozyten-Makrophagen-Systems kann sich an allen Organen entwickeln, auch in Form einer interstitiellen Lungenkrankheit. |
Ätiopathogenese
Die Ätiologie ist unbekannt. Bei 90% der Patient*innen bestehen Rauchgewohnheiten. Durch Proliferation von Langerhans-Zellen entsteht eine Granulomatose entlang der kleinsten Bronchiolen. Fehlreparaturen führen zu den typischen zystischen Veränderungen in der Lunge.
Klinik
Die Patient*innen entwickeln langsam eine Belastungsdyspnoe mit trockenem Husten, Spontanpneumothoraxe kommen häufiger vor.
Diagnostik
Die Lungenfunktionsanalyse zeigt eine Mischung aus obstruktiver und restriktiver Ventilationsstörung. Bei typischem HR-CT (feinnoduläre und retikuläre Verdichtungen mit disseminiert zystischen Veränderungen) wird die Diagnose unterstützt, wenn die bronchoalveoläre Lavage mit > 4 % CD1-positiven Zellen einhergeht. Eine transbronchiale Biopsie ist oft nicht erfolgreich, weil die Herde nicht ausreichend erreicht werden können. Daher ist die sichere histologische Diagnose nur durch eine videothorakoskopische Entnahme von Lungengewebe möglich. Inwieweit die Kryobiopsie ähnliche Ergebnisse liefert, muss noch untersucht werden.
Therapie
Offensichtlich kann sich die Lungenhistiozytose nach Raucherentwöhnung spontan zurückbilden. Bei schweren Verläufen gibt man eine orale Kortisontherapie (entsprechend einer Sarkoidosebehandlung).
Eosinophile Lungenerkrankungen
| Synonym eosinophile Pneumonien |
| Definition Eosinophile Lungenerkrankungen sind durch eine Infiltration des Lungengewebes mit eosinophilen Leukozyten gekennzeichnet. Es lassen sich acht verschiedene Formen unterscheiden (Tab. 27.13). |
|
akute eosinophile |
|
Beatmung |
|
chronische eosinophile Pneumonie |
|
|
|
Mebendazol, Albendazol |
||
|
tropische eosinophile |
|
Mebendazol, Albendazol; |
|
||
|
eosinophile Pneumonie bei Asthma bronchiale |
|
bronchoskopisches Absaugen der Sekretpfröpfe |
|
eosinophile Granulomatose mit Polyangiitis |
|
orale Kortikosteroide |
|
allergische bronchopulmonale Aspergillose |
|
Idiopathische interstitielle Pneumonien
|
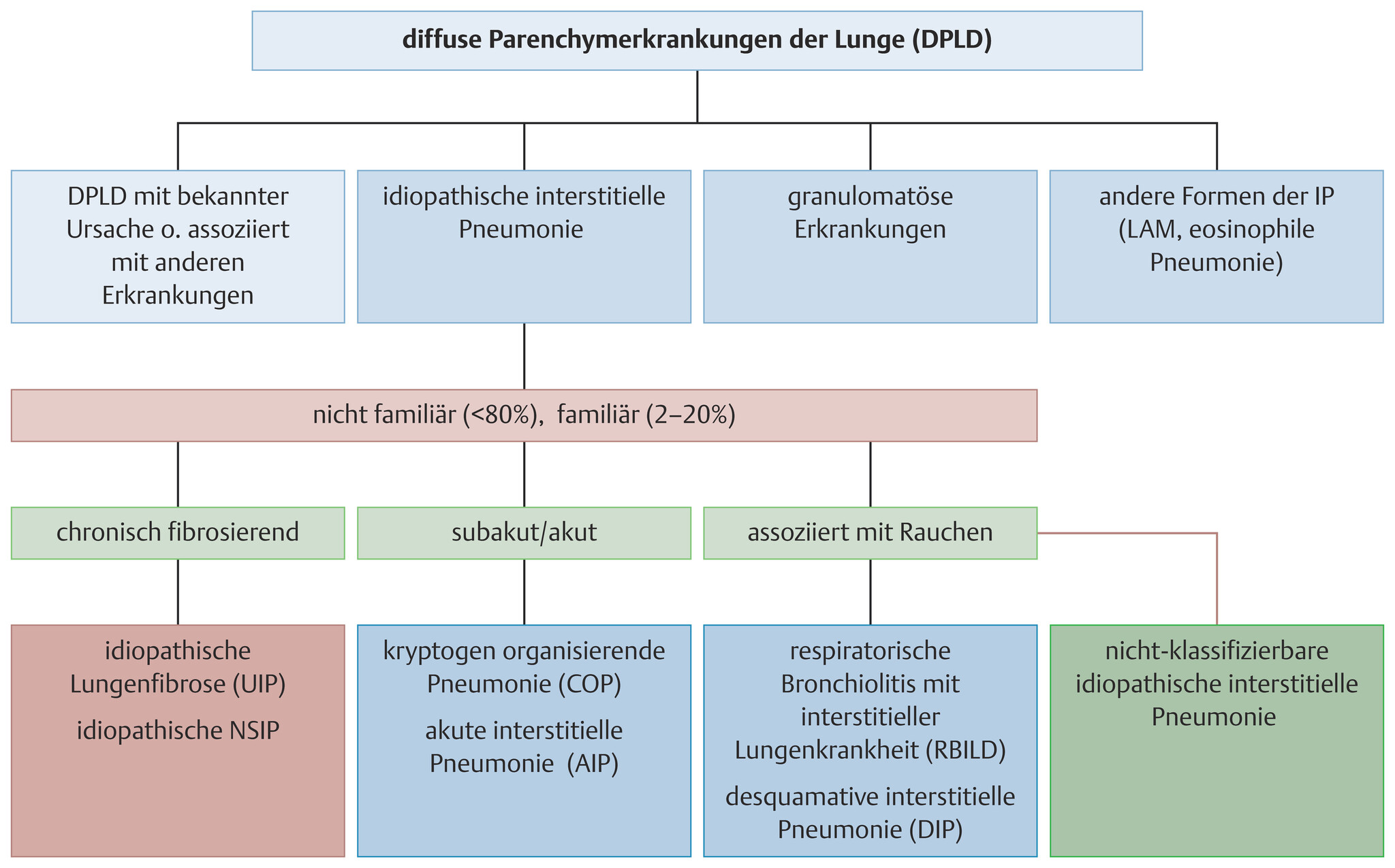
Definition Die idiopathischen interstitiellen Pneumonien gehören zu den diffusen Parenchymerkrankungen der Lunge (Abb. 27.9). Folgende Erkrankungen gehören zu dieser Gruppe :
|
Abb. 27.9 Diffuse Parenchymerkrankungen der Lunge
Idiopathische Lungenfibrose
|
Synonyme IPF = idiopathic pulmonary fibrosis. |
Epidemiologie
Neben der NSIP und der COP ist die IPF die häufigste Erkrankungsform der IIP, tritt aber insgesamt selten auf. Die Inzidenz liegt bei etwa 0,5/100 000 Einwohner*innen/Jahr.
Ätiopathogenese
Die Ätiologie ist unbekannt. Man vermutet, dass wiederholte Einwirkungen von Noxen einen sequenziellen Gewebeschaden im Bereich des Alveolarepithels und der terminalen Bronchiolen hervorrufen, der ohne fassbare Entzündung zu einer Fibrosierung des Lungenparenchyms führt. Durch die disseminierte Narbenbildung entsteht als Endstadium eine Lungenfibrose.
Klinik
Die Erkrankung beginnt meist schleichend und nimmt oft einen schubweisen Verlauf. Trockener Husten und Belastungsdyspnoe sind erste Symptome. Im Verlauf von einigen Jahren kommt es zu schwerer Dyspnoe und erheblich eingeschränkter Belastbarkeit, ggf. mit Cor pulmonale.
Diagnostik
Die Lungenfunktionsanalyse zeigt eine restriktive Ventilationsstörung mit gestörtem CO-Transfer. Bei leichter Belastung (40 Watt) wird die Hypoxämie sichtbar. Die Röntgen-Thorax-Übersicht zeigt relativ spät kleinfleckige bis streifige Einlagerungen mit hohem Zwerchfellstand beidseits und unscharfen Herz- und Zwerchfellkonturen. Das HR-CT ist dabei die wichtigste diagnostische Methode. In der thorakalen HR-CT sind auch frühe interstitielle Veränderungen zu erkennen. Es kommen zystische Umbauzonen des Lungengewebes zur Darstellung (Honigwaben) (Abb. 27.10). Dabei zeigt sich ein typisches Muster mit in den basalen Lungenabschnitten betonten sogenannten Traktionsbronchiektasen und Honigwaben (radiologisch auch als UIP(usual interstitial pneumonia)-Muster bezeichnet, s.u.). Sind diese Kriterien erfüllt (Major Kriterien) und wenn die klinischen Befunde ebenfalls für eine IPF sprechen, ist nach den internationalen Vorgaben keine histologische Sicherung der Diagnosestellung erforderlich. Histologisch ist die IPF durch das sogenannte UIP-Muster gekennzeichnet, mit dem Nachweis von Strukturstörungen, heterogenen Mustern und dem Nachweis von Fibroblastenfoci (Ansammlung von Fibroblasten).
Die zutreffende Diagnose ist in vielen Fällen nur durch eine interdisziplinäre Konferenz mit Kliniker*innen, Radiolog*innen und Patholog*innen möglich.
 © Pfeifer M. Nicht infektiöse Erkrankungen des Lungenparenchyms (= interstitielle Lungenerkrankungen, ILD). In: Arastéh K, Baenkler H, Bieber C, Boesecke C, Brandt R, Bruns B, Bugaj T, Chatterjee T, Ditting T et al., Hrsg. Duale Reihe Innere Medizin. 5., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b000000592
© Pfeifer M. Nicht infektiöse Erkrankungen des Lungenparenchyms (= interstitielle Lungenerkrankungen, ILD). In: Arastéh K, Baenkler H, Bieber C, Boesecke C, Brandt R, Bruns B, Bugaj T, Chatterjee T, Ditting T et al., Hrsg. Duale Reihe Innere Medizin. 5., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b000000592
 © Pfeifer M. Nicht infektiöse Erkrankungen des Lungenparenchyms (= interstitielle Lungenerkrankungen, ILD). In: Arastéh K, Baenkler H, Bieber C, Boesecke C, Brandt R, Bruns B, Bugaj T, Chatterjee T, Ditting T et al., Hrsg. Duale Reihe Innere Medizin. 5., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b000000592
© Pfeifer M. Nicht infektiöse Erkrankungen des Lungenparenchyms (= interstitielle Lungenerkrankungen, ILD). In: Arastéh K, Baenkler H, Bieber C, Boesecke C, Brandt R, Bruns B, Bugaj T, Chatterjee T, Ditting T et al., Hrsg. Duale Reihe Innere Medizin. 5., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b000000592
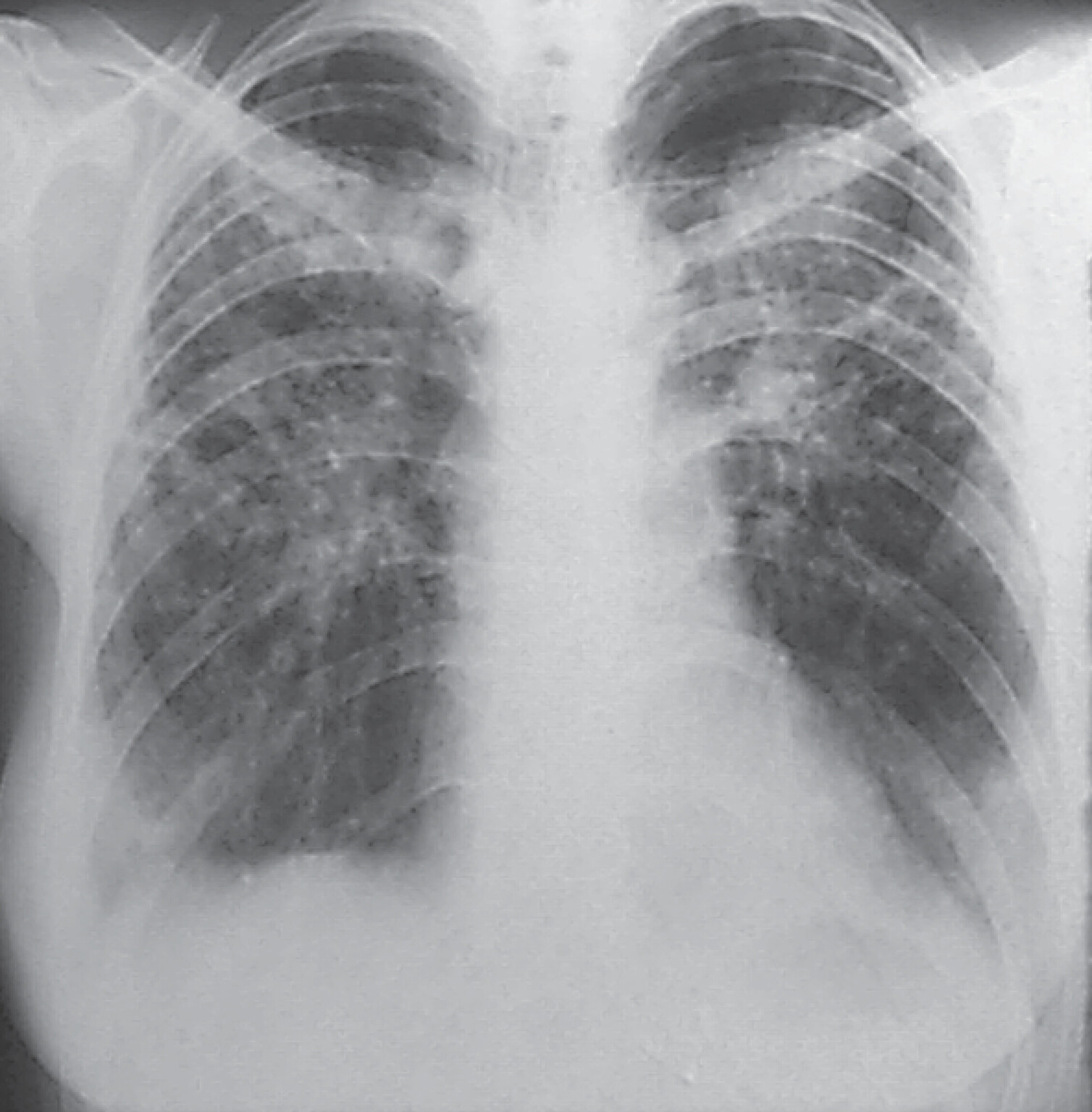
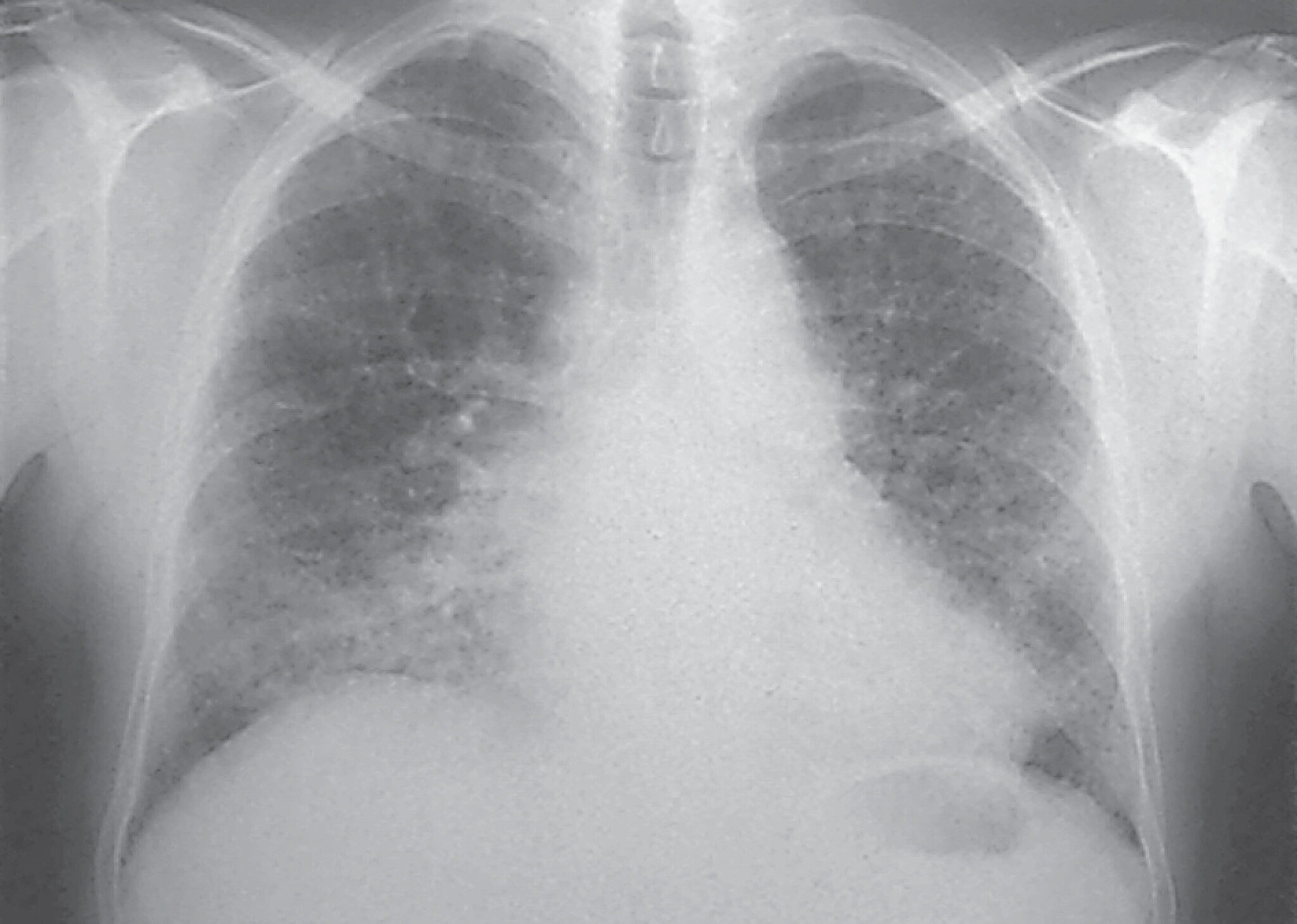
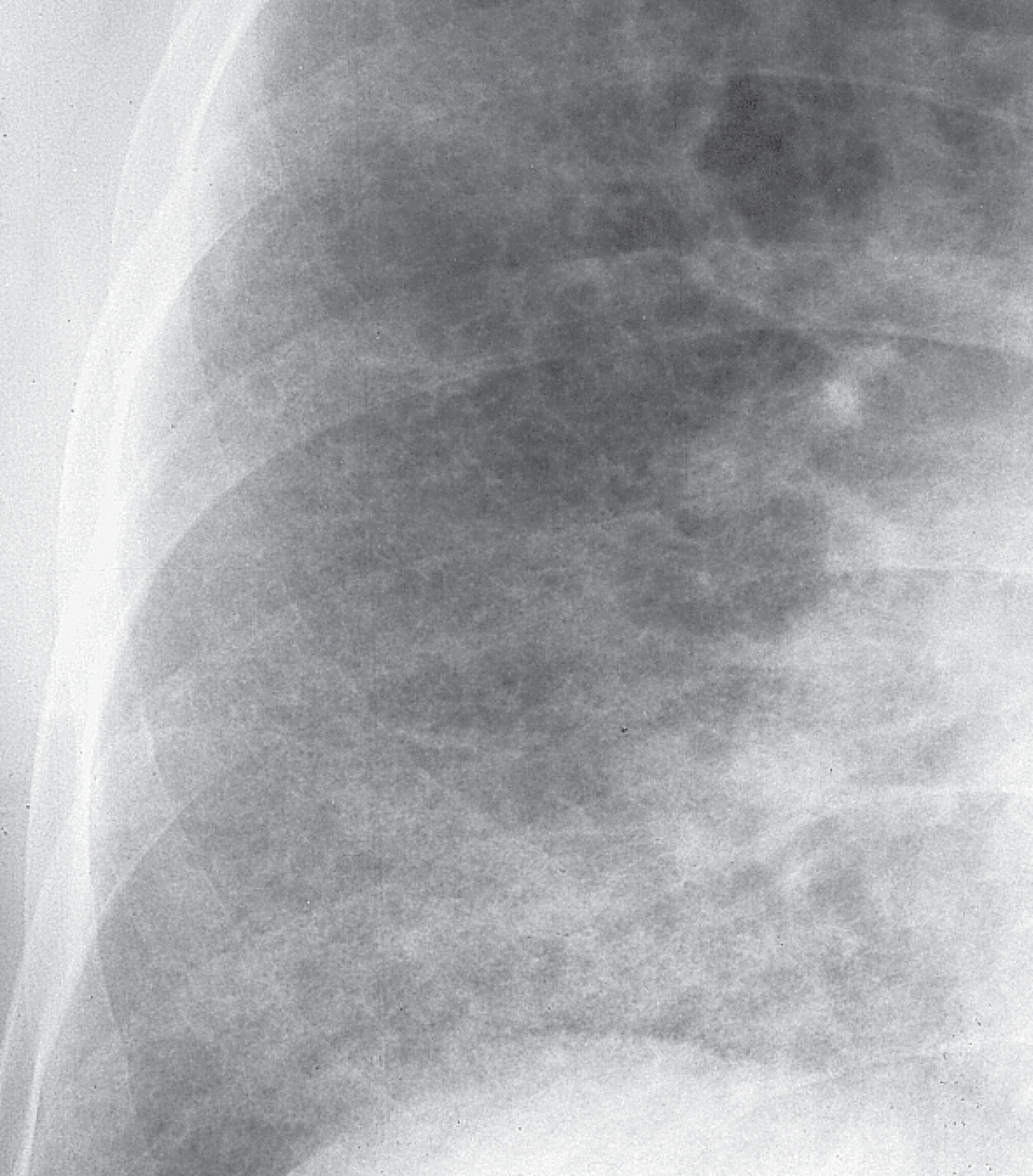
Abb. 27.10 Idiopathische Lungenfibrose
a Übersichtsaufnahme. Zwerchfellhochstand beidseits, unscharfe Abgrenzung der Herz- und Zwerchfellkonturen.
b Detailaufnahme rechtes Unter- und Mittelfeld. Kleinfleckige Zeichnungsvermehrung mit kleinzystischem Umbau („Honigwabenlunge“).
Differenzialdiagnosen
Alle interstitiellen Lungenkrankheiten bekannter Ursache sind auszuschließen (Tab. 27.10).
Therapie
Die Therapie der IPF umfasst allgemeine Maßnahmen wie Sauerstofftherapie und eine spezifische medikamentöse Behandlung mit den antifibrotischen Substanzen Pirfenidon und dem Tyrosin-Rezeptor-Antagonisten Nintendanib . Frühere Therapien mit Prednisolon und Azathioprin sind nicht effektiv und zeigen in Studien eine Übersterblichkeit. Da jedoch grundsätzlich mit den neueren Medikamenten nur eine Verzögerung der Progression erreicht werden kann, muss bei jüngeren Patient*innen (Alter < 65 Jahre) frühzeitig eine Lungentransplantation in Erwägung gezogen werden.
Prognose
Die Lebenserwartung einer IPF ist kurz. Ab Diagnosestellung liegt sie unbehandelt bei etwa 3–5 Jahren.
Literatur
Quelle
Pfeifer M. Nicht infektiöse Erkrankungen des Lungenparenchyms (= interstitielle Lungenerkrankungen, ILD). In: Arastéh K, Baenkler H, Bieber C, Boesecke C, Brandt R, Bruns B, Bugaj T, Chatterjee T, Ditting T et al., Hrsg. Duale Reihe Innere Medizin. 5., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2024.
eRef-Link: https://eref.thieme.de/ebooks/cs_24127647#/ebook_cs_24127647__819809F5_43A8_45C2_96C4_B0B1ECB04C07