Rheumatoide Arthritis
Pneumologie
Steckbrief
Pulmonale Veränderungen zählen zu den häufigsten extraartikulären Manifestationen der rheumatoiden Arthritis (RA). Die Lungenmanifestation der RA ist oft prognosebestimmend und steigert neben den kardiovaskulären und infektiösen Komplikationen die Mortalität der Patienten. Die RA-ILD manifestiert sich meist als UIP (Usual Interstitial Pneumonia) und seltener als NSIP (Non-Specific Interstitial Pneumonia). Patienten mit einer RA haben darüber hinaus ein erhöhtes Risiko, an einem Bronchialkarzinom zu erkranken.
Synonyme
- RA-ILD
Keywords
- Rheumatoide Arthritis, interstitielle Lungenerkrankung
Definition
- Die RA ist eine chronische, symmetrische, polyartikuläre Arthritis. Rheumafaktoren (RF) und Antikörper gegen citrullinierte Proteine (CCP-Ak) lassen sich bei vielen Patienten im Serum nachweisen.
- Die interstitielle Lungenerkrankung assoziiert mit rheumatoider Arthritis (RA-ILD) manifestiert sich klinisch durch Husten und Dyspnoe oder wird im Frühstadium ohne klinische Symptome lungenfunktionell oder bildgebend auffällig.
Epidemiologie
Häufigkeit
- Inzidenz RA: 20–40/100000
- Prävalenz RA: 0,3–1% der Bevölkerung
- Angaben zu Inzidenz und Prävalenz der RA-ILD variieren entsprechend den untersuchten Kohorten erheblich. Etwa 10% der RA-Patienten entwickeln eine symptomatische RA-ILD. Veränderungen im Computertomogramm (CT) oder in Lungenfunktionstests finden sich bei 15–58% aller RA-Patienten. Eine ILD tritt meist in den ersten 5 Jahren der RA auf [1]. Bis zu ⅔ der Patienten mit RA-ILD zeigen ein UIP Muster [2].
Altersgipfel
- Beginn der RA meist zwischen 50. und 70. Lebensjahr
- Altersgipfel für die RA-ILD 60–70 Jahre
Geschlechtsverteilung
- Frauen : Männer: 3 : 1
- bei RA-ILD überwiegen Männer und Raucher/ehemalige Raucher
Prädisponierende Faktoren
- Patienten assoziierte Faktoren für eine RA-ILD sind das männliche Geschlecht und höheres Lebensalter, während zu den krankheitsassoziierten Faktoren die Dauer der RA, die Schwere der Gelenkdestruktion sowie der Nachweis von Rheumafaktoren und Anti-citrullinierten Protein-Antikörpern (ACPA) zählen.
- Als Umweltfaktoren sind Rauchen, Exposition gegenüber Staub, Rauch oder metallischen Dämpfen beschrieben [3].
Ätiologie und Pathogenese
- Obwohl der Mechanismus der Entwicklung einer RA-ILD bisher nicht komplett aufgeklärt ist, sind genetische und Umweltfaktoren sicher daran beteiligt. Im Zentrum steht der posttranslationale Prozess der Citrullinierung von Arginin zu Citrullin.
- Möglich ist eine Immunantwort auf citrullinierte Proteine im synovialen Gewebe der Gelenke mit einer folgenden Kreuzreaktion gegen ähnliche Proteine in der Lunge.
- Eine 2. Hypothese geht von einem primären Zusammenbruch der Immuntoleranz in der Lunge aus, in deren Folge die ILD eine Immunantwort gegen citrullinierte Proteine triggert, die sich sekundär in die Gelenke verlagert [4].
Klassifikation und Risikostratifizierung
- Es wird zwischen mehreren Phänotypen der RA-ILD unterschieden. Die häufigste Form ist, im Unterschied zu den anderen kollagenoseassoziierten ILD, das UIP-Muster.
- Weiterhin können ein NSIP-Muster, eine lymphyzytäre interstitielle Pneumonie (LIP) oder eine organisierende Pneumonie (OP) gefunden werden.
- Neben der ILD finden sich folgende weitere pleuropulmonale Manifestationen der RA:
- Pulmonale Rheumaknoten: seltene Befunde, mikroskopisch kleine bis mehrere cm große Herde, meist als periphere Rundherde imponierend, die einschmelzen können (nekrobiotische Noduli). Besonderheit: Caplan-Syndrom: Trias aus RA, Silikose und pulmonalen Rheumaknoten mit Staubpartikeln im Zentrum.
- Atemwegserkrankungen: Bronchiektasen in 30%, seltener follikuläre Bronchiolitis mit lymphoider Hyperplasie, im HRCT als zentrilobuläre Noduli und Tree-in-bud-Zeichen imponierend.
- Pleurabeteiligung in Form von Ergüssen und Pleuraverdickungen, besonders bei erhöhter Krankheitsaktivität mit hohem Rheumafaktor, post mortem bei 40–75% der Patienten nachgewiesen.
- Pulmonale Hypertonie als Folge einer RA-assoziierten pulmonalen Vaskulitis, selten auftretend, klinisch und morphologisch kein Unterschied zur pulmonal-arteriellen Hypertonie.
Symptomatik
- In den meisten Fällen geht die Gelenkmanifestation der pulmonalen Manifestation voraus (80–90%).
- Unter differenzialdiagnostischen Aspekten sollte jedoch die RA-ILD bei der Abklärung einer interstitiellen Lungenerkrankung bedacht werden, da sich die rheumatoide Arthritis auch später manifestieren kann.
- Die klinische Symptomatik ähnelt der einer idiopathischen ILD.
- Führend sind Dyspnoe und Husten, wobei die Dyspnoe aufgrund der durch die Gelenksymptome eingeschränkten physischen Leistungsfähigkeit lange maskiert sein kann.
Diagnostik
Diagnostisches Vorgehen
- Die Diagnose der rheumatoiden Arthritis wird anhand der ACR/EULAR Klassifikationskriterien (2010) gestellt.
- Darin werden nach einem Score-System betroffene Gelenke, Entzündungsmarker (CRP/BSR), Antikörper (RF/Anti-CCP) und die Dauer der Symptome zusammengefasst.
- Für die Diagnostik der interstitiellen Lungenerkrankung ist neben der funktionellen Diagnostik die CT-Diagnostik von zentraler Bedeutung.
- In speziellen Situationen kann eine histologische Diagnostik erwogen werden.
Anamnese
- Arthritis, Husten, Dyspnoe
Körperliche Untersuchung
- bilaterales inspiratorisches Knisterrasseln
- Uhrglasnägel
- in Spätstadien Tachynoe , Zyanose, Ödeme, Zeichen der pulmonalen Hypertonie
Labor
- CRP, BSG, Anti-CCP, RF
Bildgebende Diagnostik
Röntgen
- Konventionelles Röntgen ist für das Screening der RA-ILD nicht ausreichend sensitiv.
CT
- Die HRCT-Diagnostik des Thorax ist die Methode der Wahl für die Diagnostik der RA-ILD.
- Das Spektrum der Veränderungen ist vielfältig und beinhaltet Milchglas-Opazitäten, Bronchiektasen , lineare Verdichtungen und/oder Honeycombing .
- Während retikuläre Veränderungen, Traktionsbronchiektase und Honeycombing typisch für das UIP-Muster sind, finden sich Milchglas-Opazitäten bei der NSIP und Konsolidierungen weisen auf eine OP hin.
- Pulmonale Rundherde (Rheumaknoten) können in unterschiedlicher Größe und Anzahl vorhanden sein und sind meist mit kutanen Rheumaknoten assoziiert.
Fallbeispiel
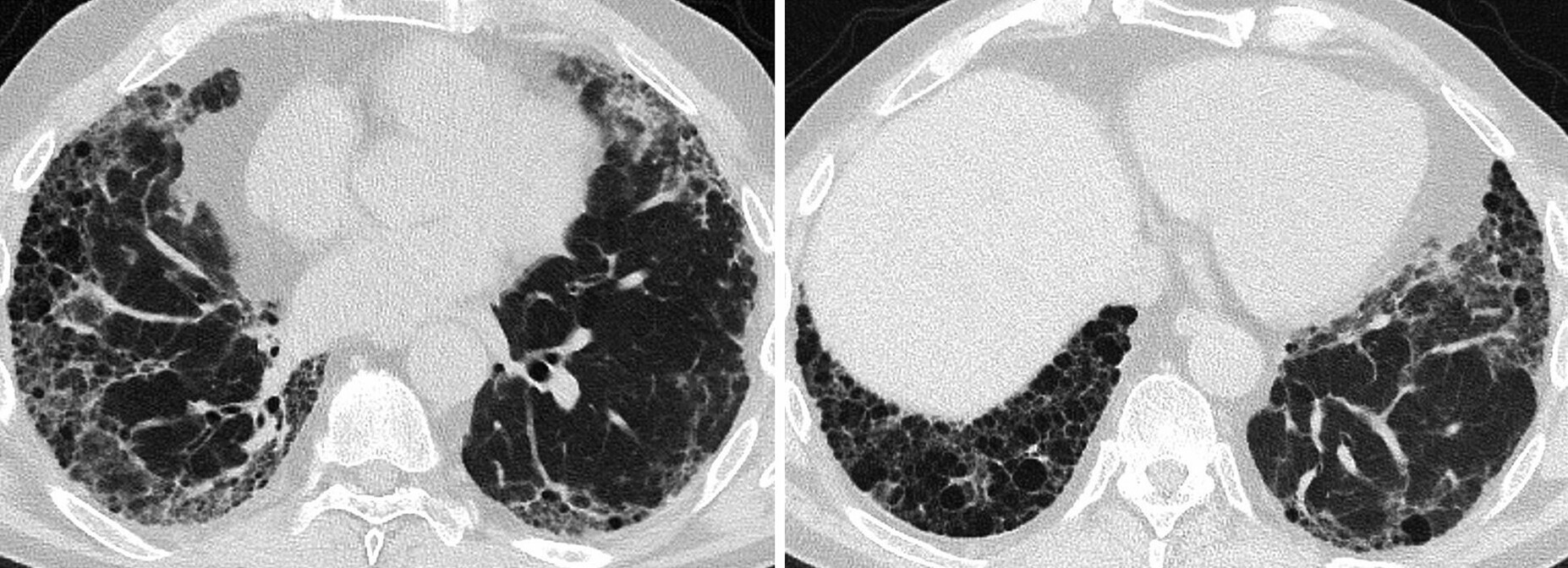
Lungenfibrose bei rheumatoider Arthritis
Ein 64-jähriger Mann, Exraucher, präsentiert sich mit einer symmetrischen Polyarthritis unter Beteiligung der Hand- und Fingergelenke. Es besteht keine systemische Entzündung (CRP und BSR normal). Rheumafaktoren (158IU/ml, normal <3,5IU/ml) und CCP-Ak (63U/ml, normal <7U/ml) sind erhöht. Entsprechend den Kriterien des American College of Rheumatology (ACR) von 2010 gilt die Diagnose einer RA mit 9 Punkten (mind. 6) als gesichert. Radiologische Veränderungen an Händen und Füssen bestehen nicht. Der Disease Activity Score (DAS) 28 wird mit 4,25 berechnet, was eine aktive RA anzeigt (>2,6). Er berichtet weiterhin über eine Belastungsdyspnoe und Husten. Die Lungenfunktion zeigt eine mittelschwere restriktive Ventilationsstörung mit eingeschränkter Diffusionskapazität.
In der BAL stellt sich ein unspezifischer Befund dar (leicht erhöhte Gesamtzellzahl, 43,7% Granulozyten, 14% eosinophile Granulozyten).
Das CT der Lunge zeigt basal betonte und periphere retikuläre Verdichtungen, teils mit umgebendem Milchglasmuster und subpleuralen Tranktionsbronchiektasen, mit möglichem UIP-Muster vereinbar (Abb. 166.1).
Abb. 166.1 Lungenfibrose bei rheumatoider Arthritis.
(Quelle: Dr. Jörg-Thomas Kluckert, Netzwerk Radiologie, Kantonsspital St. Gallen, Schweiz)
Instrumentelle Diagnostik
Lungenfunktion
- Die Lungenfunktionsuntersuchung ist sowohl Bestandteil der initialen Diagnostik als auch des regelmäßigen Screenings auf eine RA-ILD.
- Es findet sich ein restriktives Muster mit einer verminderten DLCO-Kapazität.
Bronchoskopie
- Eine Bronchoskopie mit BAL/Biopsie kann notwendig sein, wenn die Lungenveränderungen sich anhand der klinischen und bildgebenden Befunde nicht eindeutig einordnen lassen.
BAL
- Die BAL ist unspezifisch.
- die Neutrophilen/Eosinophilen sind oft bei der UIP erhöht und eine Lymphozytose findet sich häufiger bei der NSIP.
Histologie, Zytologie und klinische Pathologie
Histologische Lungendiagnostik
- Im Vergleich zur idiopathischen Lungenfibrose (IPF) ist das gleichzeitige Auftreten eines UIP-Musters mit einer chronischen Pleuritis und einer follikulären oder zellulären Bronchiolitis charakteristisch.
- Bronchioläre chronisch entzündliche Infiltrate, interlobuläre lymphoide Hyperplasie, Bronchiolitis obliterans mit organisierender Pneumonie können zusätzliche histologische Zeichen der RA-ILD sein.
Differenzialdiagnosen
- Lungenveränderungen bei RA können auch durch medikamentös-toxische Nebenwirkungen (Methotrexat, Leflunomid, Cyclophosphamid, Azathioprin, TNF-Antagonisten) oder durch eine Infektion verursacht sein.
- Auch andere interstitielle Lungenerkrankungen (z.B. exogen-allergische Alveolitis) sind auszuschließen.
- Pulmonale Rheumaknoten sollten im Verlauf beobachtet werden, um sie sicher von malignen Veränderungen zu differenzieren.
Therapie
- Die Therapie der RA-ILD orientiert sich an der Subklassifikation entsprechend UIP oder NSIP.
- Während bei der UIP bereits früh eine antifibrotische Therapie analog zur idiopathischen Lungenfibrose erfolgen kann, ist die Therapie des NSIP-Musters zunächst immunmodulatorisch und nur bei Progress trotz immunmodulatorischer Therapie sollte eine antifibrotische Therapie erwogen werden.
- Die Intensität der Therapie ist abhängig von Ausmaß, klinischer Manifestation und Progression der RA-ILD.
Therapeutisches Vorgehen
- Die medikamentöse Therapie der RA-ILD basiert initial auf dem Einsatz von Glukokortikoiden.
- Nach einem Ansprechen auf diese Therapie muss entschieden werden, welche weiteren immunsuppressiven Medikamente eingesetzt werden können, um sowohl die Arthritis als auch die ILD zu kontrollieren.
- Dabei sind sowohl die potenziellen Nebenwirkungen der Glukokortikoidtherapie zu berücksichtigen als auch potenziell toxische Effekte einzelner Immunsuppressiva auf die Lunge (Methotrexat, Leflunomid, TNF-Inhibitoren).
Allgemeine Maßnahmen
-
Rauchstopp, Sauerstofftherapie, pulmonale Rehabilitation, Impfungen
Pharmakotherapie
Glukokortikoide
- Basis der Therapie: werden in einer Dosis von 0,5mg/kg begonnen und über die folgenden Monate reduziert [5].
- Patienten mit etablierter RA befinden sich zum Zeitpunkt der Diagnose der RA-ILD bereits unter einer Therapie mit konventionellen oder biologischen Disease Modifying Antirheumatic Drugs (cDMARD, bDMARD).
- Eine Anpassung dieser Therapie muss im Kontext der RA-ILD entschieden werden. Mycophenolat Mofetil (MMF) oder Azathioprin (AZA) können ergänzt werden, wobei zu berücksichtigen ist, dass beide Medikamente nur einen moderaten Effekt auf die Arthritis haben.
- Weder zu MMF und AZA noch zu weiteren immunsuppressiven Medikamenten (Cyclophosphamid, Ciclosporin, Tacrolimus) liegen ausreichende Daten bei der RA-ILD vor.
- Leflunomid und TNF-α-Blocker sollten vermieden werden.
- In unkontrollierten Studien konnte gezeigt werden, dass sich die RA-ILD unter einer Therapie mit Rituximab, Abatacept oder Tocilizumab stabilisierte oder verbesserte.
- Retrospektive Daten zeigen, dass die Therapie mit JAK-Kinase Inhibitoren (Tofacitinib, Baricitinib) eine Behandlungsalternative für Patienten mit RA-ILD darstellen, allerdings bisher nur in kleinen Fallserien untersucht.
Antifibrotische Therapie
- Diese kann bei RA-UIP, aber auch bei jeder anderen unter immunsuppressiver Therapie progredienten fibrotischen RA-ILD eingesetzt werden.
- Die Wirksamkeit von Nintedanib, welches für diese Indikation inzwischen zugelassen ist, und Pirfenidon konnte in jeweils einer plazebokontrollierten Phase III Studie belegt werden.
Verlauf und Prognose
- Die RA-ILD ist nach der kardialen Komorbidität die zweithäufigste Ursache für ein frühes Versterben mit einer RA.
- Das mediane Überleben beträgt 7 Jahre [6].
- Der wesentliche Prädiktor für die Mortalität ist das Alter der Patienten, darüber hinaus sind das männliche Geschlecht, eine deutlich eingeschränkte Lungenfunktion sowie das Ausmaß der Fibrose im CT prognosebestimmend.
- Durch intensive immunsuppressive Therapien verbessert sich das Überleben im Vergleich zu früheren Auswertungen.
- Die Prognose der UIP ist schlechter als der NSIP.
- Der Outcome verschlechtert sich, wenn eine PH zusätzlich auftritt.
Literatur
Quellenangaben
-
[1] Bongartz T, Nannini C, Medina-Velasquez YF et al. Incidence and mortality of interstitial lung disease in rheumatoid arthritis: a population-based study. Arthritis Rheum 2010; 62(6): 1583–1591
Suche in: PubMed Google Scholar -
[2] Nurmi HM, Purokivi MK, Karkkainen MS et al. Variable course of disease of rheumatoid arthritis-associated usual interstitial pneumonia compared to other subtypes. BMC Pulm Med 2016; 16(1): 107
Suche in: PubMed Google Scholar -
[3] Sparks JA, He X, Huang J et al. Rheumatoid Arthritis Disease Activity Predicting Incident Clinically Apparent Rheumatoid Arthritis-Associated Interstitial Lung Disease: A Prospective Cohort Study. Arthritis Rheumatol 2019; 71(9): 1472–1482
Suche in: PubMed Google Scholar -
[4] Spagnolo P, Lee JS, Sverzellati N et al. The Lung in Rheumatoid Arthritis: Focus on Interstitial Lung Disease. Arthritis Rheumatol 2018; 70(10): 1544–1554
Suche in: PubMed Google Scholar -
[5] Bradley B, Branley HM, Egan JJ et al. Interstitial lung disease guideline: the British Thoracic Society in collaboration with the Thoracic Society of Australia and New Zealand and the Irish Thoracic Society. Thorax 2008; 63(Suppl 5): v1–58
Suche in: PubMed Google Scholar -
[6] Hyldgaard C, Ellingsen T, Hilberg O et al. Rheumatoid Arthritis-Associated Interstitial Lung Disease: Clinical Characteristics and Predictors of Mortality. Respiration 2019; 98(5): 455–460
Suche in: PubMed Google Scholar
Herausgeber*innen, Autor*innen und Aktualisierung
Herausgeber*innen: Claus Kroegel, Ulrich Costabel, Robert Bals, Christian Taube
Autor*innen: Thomas Neumann, Ulrich Costabel, Claus Kroegel
Letzte Änderung: 20.03.2024