Systemische Sklerose
Dermatologie
Steckbrief
Die systemische Sklerose (SSc) ist eine seltene, chronisch-entzündliche Systemerkrankung, die durch Inflammation, Vaskulopathie im Sinne einer Hyperreagibilität und zunehmender Gefäßobliteration sowie Fibrose der Haut und der inneren Organe gekennzeichnet ist. Es handelt sich um eine den Kollagenosen zugeordnete Autoimmunerkrankung bislang unvollständig verstandener Pathogenese mit Nachweis von Antikörpern gegen Zellkernbestandteile (ANA [antinukleäre Antikörper]) und von SSc-spezifischen Antikörpern. Der Krankheitsverlauf ist sehr heterogen, die Erkrankung ist mit einer hohen Morbidität und Mortalität assoziiert.
Aktuelles
-
CAR-T-Zell-Therapie könnte zukünftig bei schweren, therapierefraktären Verläufen eine neue Therapieoption bei der Systemischen Sklerose darstellen.
Synonyme
progressive systemische Sklerose; systemische Sklerodermie; Sklerodermie; Systemic Sclerosis (engl.); Scleroderma (engl.)
Keywords
Lungenfibrose; pulmonal-arterielle Hypertonie (PAH); Raynaud-Syndrom; digitale Ulzera; ICD10:M34
Definition
- seltene, chronisch-entzündliche, systemische Autoimmunerkrankung
- Kollagenose
- gekennzeichnet durch Inflammation, Vaskulopathie sowie Fibrose der Haut und der inneren Organe
- Nachweis von Antikörpern (AK) gegen Zellkernbestandteile (ANA) und von SSc- spezifischen Antikörpern
Epidemiologie
Häufigkeit
- seltene Erkrankung
- Prävalenz: ca. 300 Erkrankte pro 1 Mio. Erwachsene
- Inzidenz: ca. 50 Neuerkrankungen pro 1 Mio. Erwachsene
Altersgipfel
- Erstmanifestation zwischen 34 und 60 Lebensjahren
- mittleres Erkrankungsalter: ca. 46 Jahre
Geschlechtsverteilung
- Frauen sind häufiger betroffen als Männer (Verhältnis 4:1 bis 10:1).
- Männer haben ein höheres Risiko für eine diffus-kutane Verlaufsform.
Prädisponierende Faktoren
- ethnische Einflüsse: 2,5-fach höhere Inzidenz sowie erhöhte Morbidität und Mortalität bei Patienten mit afroamerikanischer Abstammung
Ätiologie und Pathogenese
Ätiologie
- Belastung mit Umweltreizen (Lösungsmittel, Feinstaub, Mineralöle, Dieselabgase, Silikone) sind mit dem Auftreten einer SSc assoziiert.
- Genetische Assoziationen mit HLA-Antigenen sowie das Immunsystem betreffende genetische Polymorphismen sind bekannt.
- Es besteht eine Dysbalance funktioneller AK z.B. gegen vaskuläre Angiotensin- und Endothelinrezeptoren sowie gegen Wachstumsfaktoren und ihre Rezeptoren.
Pathogenese
- komplex und bislang nur teilweise verstanden
- Beteiligung des angeborenen (Schlüsselfunktion von Monozyten) sowie des adaptiven (T- und B-Zellen, Autoantikörperproduktion) Immunsystems
- Inflammation, Vaskulopathie und Fibrose, vermutlich Antikörper-getriggert
Klassifikation und Risikostratifizierung
-
Die EULAR/ACR-Klassifikation der systemischen Sklerose ist in Tab. 89.1 wiedergegeben.
|
der Finger beider Hände bis proximal der MCP |
||
|
pathologische Kapillarmikroskopie |
||
|
pulmonalarterielle Hypertonie |
||
|
MCP: Metakarpophalangealgelenk, PIP: proximales Interphalangealgelenk, RNA: Ribonukleinsäure SSc-Klassifizierung ≥9 Punkte möglich (Sensitivität 91%, Spezifität 92%) Hinweis: Kriterien sind nicht anzuwenden bei SSc-imitierenden Erkrankungen und bei Patienten, bei denen die Hautsklerose die Finger ausspart. |
||
- Verlaufsformen:
- limitiert-kutan (lcSSc)
- ca. 50%
- Hautsklerose auf das Gesicht und die Extremitäten distal der Ellenbogen und Knie beschränkt
- diffus-kutan (dcSSc)
- ca. 32%
- Hautsklerose zumindest einmalig auch proximal der Ellenbogen- oder Kniegelenke mit Befall von Oberarmen, Thorax, Abdomen oder Oberschenkel
- prognostisch ungünstig
- systemische Sklerose sine scleroderma
- selten, <5%
- limitiert-kutan (lcSSc)
Symptomatik
- Raynaud-Syndrom
- häufig Erstsymptom
- ca. 90–95% der Patienten
- durch Kälteexposition und/oder emotionalen Stress ausgelöste, anfallsartige arterielle Durchblutungsstörung der Finger und teils der Füße
- Tricolorephänomen (initial Weiß-, anschließend Blau-, zuletzt Rotverfärbung der Finger), häufig unvollständig
- DD primäres und sekundäres Raynaud-Syndrom
- Hautsklerose
- beginnend an den Fingern, Ausbreitung nach proximal
- Juckreiz
- gastrointestinale Beschwerden
- ca. 70% der Patienten
- Refluxsymptomatik
- Dysphagie
- Obstipation/Diarrhö
- Stuhlinkontinenz
- Small Intestine Bacterial Overgrowth (SIBO) (bakterielle Überwucherung des Dünndarms)
- gastral-antrale vaskuläre Ektasie (GAVE-Syndrom)
- Dyspnoe, Husten
- Schwindel, Palpitationen
- Arthritis, Arthralgien, Morgensteifigkeit
- Myalgien, Kontrakturen, Sehnenverkürzungen
- Polyneuropathie
- Gewichtsverlust
- Fatigue
- sexuelle Dysfunktion
- Störungen des Geschmacks und des Riechens
- Harninkontinenz
- Komplikationen:
- digitale Ulzera
- frühes Symptom
- Assoziation mit Teleangiektasien und pulmonal-arterieller Hypertonie (PAH)
- PAH
- bei ca. 10–20% der Patienten
- kann zu jedem Zeitpunkt der Erkrankung auftreten
- besonders bei Patienten mit spätem Erkrankungsbeginn häufig
- renale Krise
- maligne Hypertonie, akutes Nierenversagen und/oder thrombotische Mikroangiopathie mit Hämolyse
- ohne Einsatz von Prednisolon >10 mg/Tag selten (<2%)
- Auftreten i.d.R. in den ersten 5 Krankheitsjahren
- dauerhafte Dialysepflichtigkeit in ca. 20%
- Lungenfibrose
- bei ca. 60% der SSc-Patienten, bei ca. 30% progredient
- kardiale Manifestation
- Myokarditis, Myokardfibrose, systolische und/oder diastolische Funktionsstörungen, Störungen der Reizweiterleitungen mit Herzrhythmusstörungen, Perikarderguss
- digitale Ulzera
Diagnostik
Diagnostisches Vorgehen
- Initial: Spirometrie, HR-CT-Thorax, EKG, Echokardiografie, Kapillarmikroskopie; ergänzend symptom-/befundabhängig: Bronchoskopie mit bronchoalveolärer Lavage (BAL), 6-Minuten-Gehtest, Rechtsherzkatheter, Ösophago-Gastro-Duodenoskopie (ÖGD), Ösophagusmanometrie.
- Bei Verdacht auf ein sekundäres Raynaud-Syndrom sollten ANA und Antikörper gegen extrahierbare nukleäre Antigene (ENA) oder besser SSc-spezifische Antikörper bestimmt werden (da z.B. Patienten mit RNA-Polymerase-III-Antikörpern ANA- und ENA-negativ sind).
- Patienten mit Raynaud-Syndrom und SSc-spezifischen Antikörpern erkranken zu etwa einem Drittel im Verlauf der nächsten 10 Jahre an einer SSc.
- Bei RNA-Polymerase-III-Antikörpern sollte ein paraneoplastisches Geschehen ausgeschlossen werden.
Anamnese
- Besteht ein Raynaud-Syndrom, wenn ja, seit wann?
- Besteht eine Verdickung der Haut und/oder ein Spannungsgefühl der Finger?
- Sind bereits offene Stellen an den Fingern aufgetreten?
- Bestehen Symptome wie Luftnot, Husten, Herzstolpern, Schwindel, Schluckstörungen, Refluxsymptomatik, Völlegefühl, Inkontinenz, Gelenk- oder Muskelschmerzen, Taubheitsgefühle?
Körperliche Untersuchung
- internistischer Status
- Modified Rodnan Skin Score (mRSS):
- erfasst die Hautdicke an 17 Körperregionen
- je Region wird eine Hautfalte gebildet, um den Schweregrad der Hautsklerose einzuschätzen (0 –normale Hautdicke, 1 – fragliche Hautverdickung, 2 – sichere Hautverdickung, Hautfalte lässt sich noch abheben, 3 – keine Hautfaltenbildung möglich)
- Score ergibt sich aus der Summe der 17 Regionen
- typische Untersuchungsbefunde:
- Puffy Fingers, Sklerödem, Sklerodaktylie
- Hautsklerose
- Mikrostomie mit perioraler Fältelung (früher „Tabaksbeutelmund“)
- Teleangiektasien (mit erhöhtem Risiko für digitale Ulzera oder PAH-assoziiert)
- digitale Ulzera
- Pitting Scars (grübchenförmige Narben der Fingerkuppen)
- Akroosteolysen (Auflösen der peripheren Knochen mit Verkürzung der Fingerendglieder)
- Calcinosis cutis
- Poikilodermie, Hyper-/Hypopigmentierung, Pfeffer-Salz-Muster (Kombination aus Hyper- und Hypopigmentierung)
- Skleroglosson (verkürztes und verdicktes Zungenbändchen)
- Kontrakturen, Gebetszeichen (Kontrakturen der Finger)
- Sehnenreiben
- Sklerophonie (trockenes endinspiratorisches Knistern bei Lungenfibrose)
Labor
-
großes Blutbild, CRP, BSG, Leber- und Nierenwerte, Harnsäure, CK, NT-proBNP, Troponin, β2-Mikroglobulin, löslicher IL-2-Rezeptor, Urinstatus, Proteinuriediagnostik
Autoantikörperdiagnostik
- Eine Übersicht über die Autoantikörperdiagnostik zeigt Tab. 89.2.
- ANA in 95% der Fälle positiv
- ENA sind mit klinischem Phänotyp assoziiert und haben prognostische Bedeutung, SSc-Blot ist aussagekräftiger, da seltenere AK miterfasst werden.
- Rheumafaktor, CCP-Antikörper, ggf. ANCA
- Funktionelle Antikörper gegen Endothelin- und Angiotensin- Rezeptoren sind mit vaskulären und fibrotischen Komplikationen und einer erhöhten Mortalität assoziiert.
|
diffuse SSc, pulmonale Fibrose, kardiale Manifestation, digitale Ulzera |
||
|
limitierte SSc, PAH, digitale Ulzera, primär biliäre Cholangitis (PBC) |
||
|
diffuse SSc, renale Krise, GAVE-Syndrom, können malignomassoziiert auftreten |
||
|
limitierte SSc, pulmonale Fibrose, renale Krise, Perikarditis |
||
|
Overlap mit Polymyositis, limitierte SSc, pulmonale Fibrose |
||
|
limitierte SSc, Arthritis, Myositis, Gelenkkontrakturen |
||
|
andere Autoimmunerkrankungen, pulmonale Fibrose, geringe oder fehlende Hautsklerose |
||
|
PAH: pulmonal-arterielle Hypertonie, SSc: systemische Sklerose |
||
Bildgebende Diagnostik
- Echokardiografie: Erfassung von Zeichen einer Kardiomyopathie, einer diastolischen Dysfunktion sowie von Zeichen einer PAH (Trikuspidalinsuffizienz, sPAP ≥35mmHg, TAPSE ≤20mm, vergrößerter rechter Vorhof)
- Röntgen-Thorax: bei lcSSc/Zentromer-Antikörpern und normaler Lungenfunktion ausreichend
- HR-CT-Thorax: Erfassung einer Lungenfibrose und ggf. Verlauf
- ggf. Kardio-MRT: Erfassung kardialer Manifestation
- ggf. Röntgen der Hände und Vorfüße: bei V.a. Overlap mit rheumatoider Arthritis
Instrumentelle Diagnostik
- Spirometrie inklusive Diffusionskapazität: Abnahme der Diffusionskapazität ≤80% als Ausdruck einer beginnenden Fibrose oder PAH, im Verlauf Abnahme der forcierten Vitalkapazität bei Lungenfibrose, Reduktion von FVC ≥10% und von DLCO ≥15% im Vergleich zu Vorwerten zeigt Progress an
- 12-Kanal-EKG/Langzeit-EKG: Erfassung von Herzrhythmusstörungen, VES-Last ausschlaggebend für Prognose
- Rechtsherzkatheter: zur Diagnostik bei V.a. PAH
- Bronchoskopie mit BAL: Nachweis von Alveolitis, Infektion, Tumor
- 6-Minuten-Gehtest: Erfassung der Belastbarkeit, deutliche Einschränkung bei ≤400m
- Ösophago-Gastro-Duodenoskopie (ÖGD): Nachweis von Refluxösophagitis, Teleangiektasien, GAVE-Syndrom
- Ösophagusmanometrie: Nachweis einer Ösophagusmotilitätsstörung
- H2-Atemtest: Nachweis einer bakteriellen Überwucherung des Dünndarms
- Kapillarmikroskopie: Megakapillaren, Blutungen und avaskuläre Felder sind diagnostisch wegweisend.
Differenzialdiagnosen
|
Häufigkeit der Differenzialdiagnose im Hinblick auf das Krankheitsbild (häufig, gelegentlich, selten) |
richtungsweisende Diagnostik/Befunde/zusätzliche Leitsymptome |
||
|
bilaterale symmetrische Verhärtung und Verdickung der Haut von Fingern und Handrücken |
Verdickung des subkutanen Gewebes und der Beugesehnenscheiden in Sonografie/MRT |
||
|
generalisierte Morphea („zirkumskripte Sklerodermie“) |
Autoantikörper negativ, Kapillarmikroskopie unauffällig, Hautbiopsie |
||
|
Hautfibrose mit Aussparung der Finger, Furchenzeichen/Groove Sign (Einsenkung der Haut über den Venen), Bluteosinophilie |
|||
|
Hautverdickung vor allem an Nacken, Schultern und Rücken, Aussparung der Finger, mit Infekten, Diabetes und monoklonaler Gammopathie assoziiert |
Diagnosestellung in Zusammenschau von Befallsmuster und Vorliegen einer assoziierten Erkrankung, ggf. Hautbiopsie in unklaren Fällen |
||
|
muzinöse Ablagerungen an Gesicht, Nacken, Armen, Fingern, „Kopfsteinpflasterrelief“ der Haut, meist mit monoklonaler Gammopathie/multiplem Myelom assoziiert |
Diagnosestellung in Zusammenschau von typischen papulösen Hautveränderungen, Hautbiopsie sowie der häufigen Assoziation mit monoklonaler Gammopathie, zudem Ausschluss einer Schilddrüsenfunktionsstörung |
||
|
Gesicht ausgespart, oft gelblichbräunliche Pigmentierung, Gadolinium-induziert, meist bei chronischer Niereninsuffizienz |
Therapie
Therapeutisches Vorgehen
- Die Behandlung der Patienten in spezialisierten Zentren des Deutschen Netzwerkes für systemische Sklerodermie (DNSS) wird empfohlen.
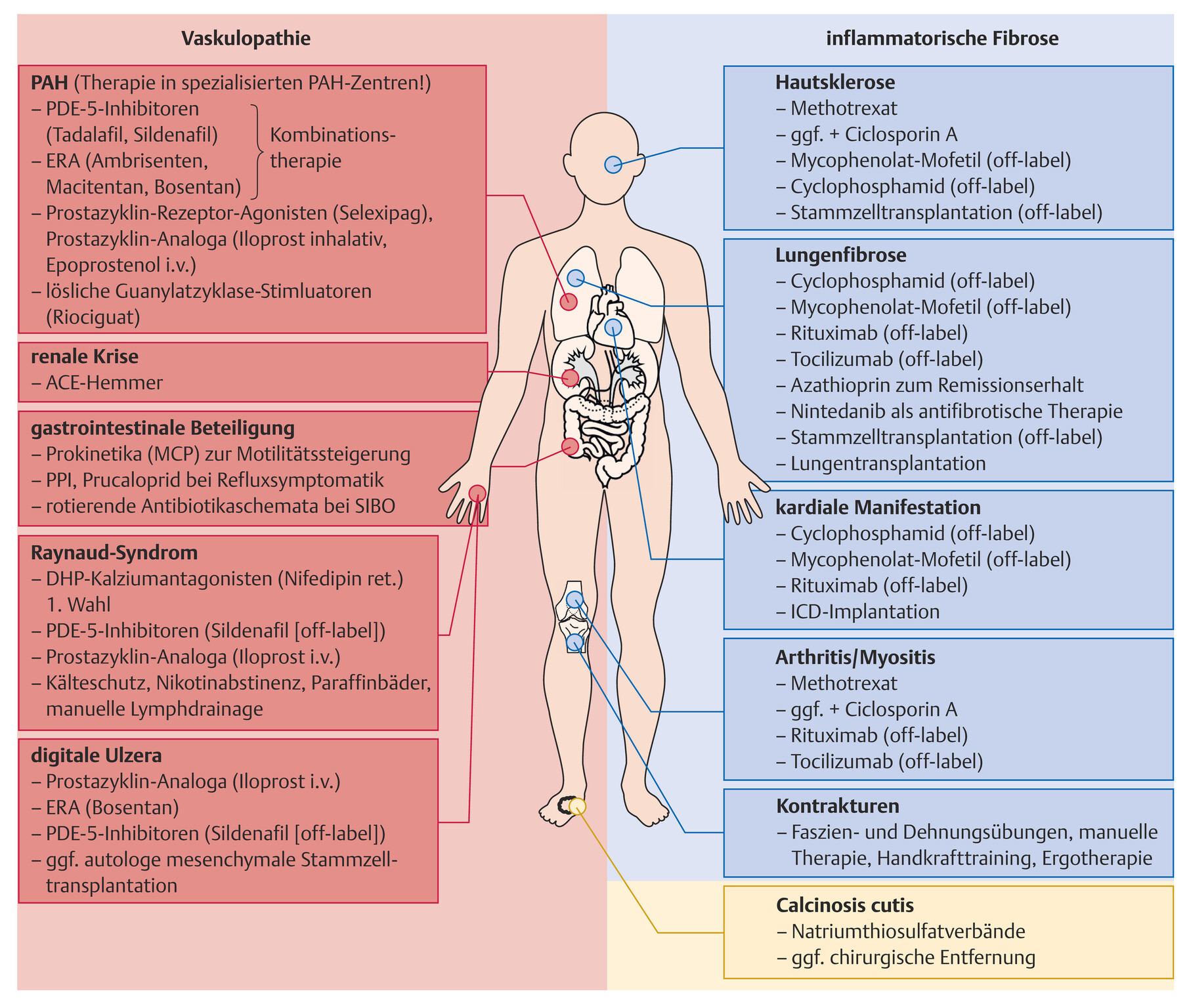
- Die Therapie richtet sich nach der Krankheitsaktivität, -schwere und den Komorbiditäten (Abb. 89.1).
- Entzündliche Manifestationen an Haut, Organen, Gelenken oder Muskeln sollen immunsuppressiv behandelt werden (Abb. 89.1).
- Tägliche Prednisolondosen ≥10 mg/Tag sollen vermieden werden, sie erhöhen das Risiko für eine renale Krise.
- autologe Stammzelltransplantation:
- verbessert das Gesamtüberleben nach 5 Jahren im Vergleich zu Cyclophosphamid über 12 Monate
- transplantationsbedingte Mortalität 6–10%
- deutliche Verbesserung der Hautfibrose und Stabilisierung Lungenfibrose
- sollte bei ungünstiger Prognose, jedoch nicht zu weit fortgeschrittener Erkrankung erwogen werden
- sollte in Zentren mit Erfahrung durchgeführt werden
- Bei schwerem Raynaud-Syndrom und digitalen Ulzera sollte eine vasoaktive Therapie mit Dihydropyridin-Calciumantagonisten, Endothelinrezeptor-Antagonisten, Iloprost i.v. und ggf. mit Phosphodiesterase-5-Inhibitoren (off-label) durchgeführt werden.
- Bei PAH ist eine Kombinationstherapie aus Endothelinrezeptor-Antagonisten und Phosphodiesterase-5-Inhibitoren besser als die jeweilige Monotherapie.
- Eine antifibrotische Therapie mit Nintedanib ist bei Lungenfibrose angezeigt.
Abb. 89.1 Systemische Sklerose.
Therapie.
Abkürzungen:
ACE-Hemmer: Angiotensinkonversionsenzym-Hemmer
DHP: Dihydropyridin
ERA: Endothelinrezeptor-Antagonisten
PDE-5-Inhibitoren: Phosphodiesterase-5-Inhibitoren
SIBO: Small intestinal bacterial Overgrowth
Nachsorge
- Ein kontinuierliches Screening auf Organschäden sollte insbesondere in den ersten 5 Jahren nach Beginn des Raynaud-Syndroms durchgeführt werden, in Abhängigkeit vom Krankheitsverlauf mindestens einmal jährlich, ggf. alle 3–6 Monate:
- mRSS
- Untersuchung auf digitale Ulzera
- Spirometrie inkl. Diffusionskapazität, bei Auffälligkeiten HR-CT des Thorax
- Labor inkl. NT-proBNP, Troponin, CK
- 6-min-Gehtest/Belastbarkeit nach NYHA-Klassifikation
Verlauf und Prognose
- heterogene Erkrankung
- 75% aller Organmanifestationen treten in den ersten 5 Jahren nach Beginn der Raynaud-Symptomatik auf
- höchste krankheitsbezogene Mortalität unter den rheumatischen Erkrankungen, Gesamtmortalität im Vergleich zur Allgemeinbevölkerung 3- bis 4-fach höher
- Haupttodesursachen: Lungenfibrose, PAH, kardiale Manifestation
- Risiko für Lungenkarzinomen 2- bis 4-fach erhöht
Literatur
Herausgeber*innen, Autor*innen und Aktualisierung
Herausgeber*innen: Ralf Ludwig, Wolf-Henning Boehncke
Autor*innen: Sabrina Arnold, Gabriela Riemekasten
Letzte Änderung: 01.05.2025